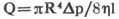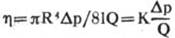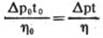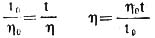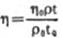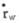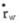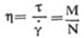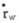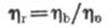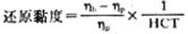原理:
(1)原理部分:
①毛细管黏度计法:毛细管黏度计的理论依据是Poiseuille公式。著名法国科学家Poiseuille研究了水在不同管径的直长硬性管道(L/2R大于或等于200)中流动的规律,发现若流动为层流状态,则管道两端压差、流量和流体黏度之间有如下关系:
(公式1)
式中,Q为流速,R为管道的半径,Ap为管道两端的压差,1为管道长度,η为流体黏度。(公式1)即为Poiseuille定律,由(公式1)可计算出流体黏度:
(公式2)
式中K为常数,由(公式2)可见黏度η与△p/Q成正比,由于Ap和Q是已知的,故可利用已知黏度的液体计算出测试温度下的黏度计常数K,由此可利用(公式2)测量待测液体的黏度。
(公式3)
目前大多数黏度计采用测量一定量的液体流过毛细管所需时间来计算出液体的黏度。设已知黏度为η0,流过时间为t0,待测液体黏度为η,流过时间为t,由(公式1)可得出:若以恒压驱动,因为△p=Ap0,故:
(公式4)
若以自身重力驱动,由于两种液体密度不同,故△p≠Ap0,所以:
(公式5)
然而需要说明的是在毛细管流动中,切变率是管径的函数,管的轴心部分为零,管壁处最大,其壁切变率
。
(公式6)
由(公式6)可见,
不仅与管半径R、压力梯度△p/L有关,而且还与流体的黏度有关。
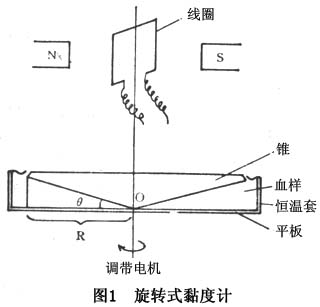
②旋转式黏度计法:常见的旋转式黏度计是同轴锥板式结构,平板部分为样品杯,它与调速马达相连,当平板以某一转速旋转时,转动的扭矩通过血样传递到锥体;血样越粘,传入的扭矩越大(图1)。锥体受力大小由与其相连的测力传感器检测,利用下式可计算被测液体的黏度η:
(公式7)
式中,N为转数(r/min),M为扭矩,K为仪器常数。它是由两个同轴部件的几何参数、角速度及应力检测装置的一些物理参数决定的,一般在仪器出厂时均已标出,用户也可根据黏度计说明书,自己标定K值。目前国内外常见的测量稳流状态下血液黏度计有日本E型黏度计,国产NXE-Ⅰ型、NZ-6型黏度计等,它们仅能作血液表观黏度测量。另一类较复杂的流变仪,它们不仅可以测量稳流状态下的血液黏度,而且可作振荡流动状态下血液黏弹性的测量,但价格昂贵。
(2)结构部分:
①毛细管黏度计法:
A.贮液池:一般位于毛细管的顶端,作暂时贮液用,贮液池和毛细管应同处于恒温环境中。
B.驱动压:从理论讲以恒压驱动为好,但最简单和普遍采用的是以液体自身重力来驱动,但在液体下流的过程中驱动压逐渐减小,故引起壁切变率
逐渐减小。
②旋转式黏度计法:
A.黏度及有关物理量的单位:根据国际单位制(SI)的规定,黏度应以mPa·s(毫帕·秒)为单位。过去常以泊或厘泊为单位,1mPa·s=1cp,黏度与其他物理量之间的关系归纳下表(表1)。
B.测试条件:
a.切变率:不同的黏度计有不同的量程。根据国际血液学标准化委员会(ICSH)的建议,测定血液黏度理想的切变率范围选择在1~200s-1。临床血液黏度测量可在此范围内选择两个以上切变率,其中一个应选择在40s-1以下,最好选择在10s-1以下,高切变率最好选在200s-1左右。
b.测试温度:液体黏度与温度成负相关,血液黏度计应该有较好的恒温控制系统,温度波动范围应小于0.5℃,测试温度选择在25℃或37℃均可。