您现在的位置:首页>帕金森病
-
+ 全部展开 -全部收缩
-
-概述
疾病概述:帕金森病(Parkinson’s disease,PD)也称为震颤麻痹(paralysis agitans,shaking palsy),是一种常见的神经系统变性疾病,临床上特征性表现为静止性震颤、运动迟缓、肌强直及姿势步态异常。病理特征是黑质多巴胺能神经元变性缺失和路易(Lewy)小体形成。
- -预防
-
+流行病学
流行病学:世界各国PD的流行病学资料表明,从年龄分布上看,大部分国家帕金森病人群发病率及患病率随年龄增长而增加,50岁以上约为500/100 000,60岁以上约为1000/100 000;白种人发病率高于黄种人,黄种人高于黑种人。我国进行的PD流行病学研究,选择北京、西安及上海三个相隔甚远的地区,在79个乡村和58个城镇,通过分层、多级、群体抽样选择29 454个年龄≥55岁的老年人样本,应用横断层面模式进行帕金森病患病率调查。依据标准化的诊断方案,确认277人罹患PD,显示65岁或以上的老人PD患病率为1.7%(95% CI:1.5-1.9),估计中国年龄在55岁或以上的老年人中约有170万人患有帕金森病。这一研究提示,中国PD患病率相当于发达国家的水平,修正了中国是世界上PD患病率最低的国家的结论(Zhang et al.2005)。预计随着我国人口的老龄化,未来我国正面临着大量的PD病例,将承受更大的PD负担。
-
+病因
研究显示,农业环境如杀虫剂和除草剂使用,以及遗传因素等是PD较确定的危险因素。居住农村或橡胶厂附近、饮用井水、从事田间劳动、在工业化学品厂工作等也可能是危险因素。吸烟与PD发病间存在负相关,被认为是保护因素,但吸烟有众多危害性,不能因PD的“保护因素”而提倡吸烟。饮茶和喝咖啡者患病率也较低。
-
+发病机制
发病机制:【发病机制】本病的发病机制复杂,可能与下列因素有关:1.环境因素 例如,20世纪80年代初美国加州一些吸毒者因误用MPTP,出现酷似原发性PD的某些病理变化、生化改变、症状和药物治疗反应,给猴注射MPTP也出现相似效应。鱼藤酮为脂溶性,可穿过血-脑屏障,研究表明鱼藤酮可抑制线粒体复合体Ⅰ活性,导致大量氧自由基和凋亡诱导因子产生,使DA能神经元变性。与MPP+结构相似的百草枯(paraquat)及其他吡啶类化合物,也被证明与帕金森病发病相关。利用MPTP和鱼藤酮制作的动物模型已成为帕金森病实验研究的有效工具。锰剂和铁剂等也被报道参与了帕金森病的发病。2.遗传因素 流行病学资料显示,近10%~15%的PD患者有家族史,呈不完全外显的常染色体显性或隐性遗传,其余为散发性PD。目前已定位13个PD的基因位点,分别被命名为PARK1-13,其中9个致病基因已被克隆。(1) 常染色体显性遗传性帕金森病致病基因:包括α-突触核蛋白基因(PARK1/PARK4)、UCH-L1基因(PARK5)、LRRK2基因(PARK8)、GIGYF2基因(PARK11)和HTRA2/Omi基因(PARK13)。①α-突触核蛋白(PARK1)基因定位于4号染色体长臂4q21~23,α-突触核蛋白可能增高DA能神经细胞对神经毒素的敏感性,α-突触核蛋白基因Ala53Thr和Ala39Pro突变导致α-突触核蛋白异常沉积,最终形成路易小体;②富亮氨酸重复序列激酶2(LRRK2)基因(PARK8),是目前为止帕金森病患者中突变频率最高的常染色体显性帕金森病致病基因,与晚发性帕金森病相关;③ HTRA2也与晚发性PD相关;④泛素蛋白C末端羟化酶-L1(UCH-L1)为PARK5基因突变,定位于4号染色体短臂4p14。(2) 常染色体隐性遗传性帕金森病致病基因:包括Parkin基因(PARK2)、PINK1基因(PARK6)、DJ-1基因(PARK7)和ATP13A2基因(PARK9)。1) Parkin基因定位于6号染色体长臂6q25.2~27,基因突变常导致Parkin蛋白功能障碍,酶活性减弱或消失,造成细胞内异常蛋白质沉积,最终导致DA能神经元变性。Parkin基因突变是早发性常染色体隐性家族性帕金森病的主要病因之一。2) ATP13A2基因突变在亚洲人群中较为多见,与常染色体隐性遗传性早发性帕金森病相关,该基因定位在1号染色体,包含29个编码外显子,编码1180个氨基酸的蛋白质,属于三磷腺苷酶的P型超家族,主要利用水解三磷腺苷释能驱动物质跨膜转运,ATPl3A2蛋白的降解途径主要有2个:溶酶体通路和蛋白酶体通路。蛋白酶体通路的功能障碍是导致神经退行性病变的因素之一,蛋白酶体通路E3连接酶Parkin蛋白的突变可以导致PD的发生。3) PINK1基因最早在3个欧洲帕金森病家系中发现,该基因突变分布广泛,在北美、亚洲及中国台湾地区均有报道,该基因与线粒体的融合、分裂密切相关,且与Parkin、DJ-1和Htra2等帕金森病致病基因间存在相互作用,提示其在帕金森病发病机制中发挥重要作用。4) DJ-1蛋白是氢过氧化物反应蛋白,参与机体氧化应激。DJ-1基因突变后DJ-1蛋白功能受损,增加氧化应激反应对神经元的损害。DJ-1基因突变与散发性早发性帕金森病的发病有关。(3) 细胞色素P4502D6基因和某些线粒体DNA突变可能是PD发病易感因素之一,可能使P450酶活性下降,使肝脏解毒功能受损,易造成MPTP等毒素对黑质纹状体损害。3.氧化应激与线粒体功能缺陷 氧化应激是PD发病机制的研究热点。自由基可使不饱和脂肪酸发生脂质过氧化(LPO),后者可氧化损伤蛋白质和DNA,导致细胞变性死亡。PD患者由于B型单胺氧化酶(MAO-B)活性增高,可产生过量OH·基,破坏细胞膜。在氧化的同时,黑质细胞内DA氧化产物聚合形成神经黑色素,与铁结合产生Fenton反应可形成OH·基。在正常情况下细胞内有足够的抗氧化物质,如脑内的谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-PX)和超氧化物歧化酶(SOD)等,因而DA氧化产生自由基不会产生氧化应激,保证免遭自由基损伤。PD患者黑质部还原型GSH降低和LPO增加,铁离子(Fe2+)浓度增高和铁蛋白含量降低,使黑质成为易受氧化应激侵袭的部位。近年发现线粒体功能缺陷在PD发病中起重要作用。对PD患者线粒体功能缺陷认识源于对MPTP作用机制研究,MPTP通过抑制黑质线粒体呼吸链复合物Ⅰ活性导致PD。体外实验证实MPTP活性成分MPP+能造成MES 23.5细胞线粒体膜电势(△Ψm)下降,氧自由基生成增加。PD患者黑质线粒体复合物Ⅰ活性可降低32%~38%,复合物Ⅰ活性降低使黑质细胞对自由基损伤敏感性显著增加。在多系统萎缩及进行性核上性麻痹患者黑质中未发现复合物Ⅰ活性改变,表明PD黑质复合物Ⅰ活性降低可能是PD相对特异性改变。PD患者存在线粒体功能缺陷可能与遗传和环境因素有关,研究提示PD患者存在线粒体DNA突变,复合物Ⅰ是由细胞核和线粒体两个基因组编码翻译,两组基因任何片段缺损都可影响复合物Ⅰ功能。近年来PARK1基因突变受到普遍重视,它的编码蛋白就位于线粒体内。4. 免疫及炎性机制 Abramsky(1978)提出PD发病与免疫/炎性机制有关。研究发现PD患者细胞免疫功能降低,白介素-1(IL-1)活性降低明显。PD患者脑脊液(CSF)中存在抗DA能神经元抗体。细胞培养发现,PD患者的血浆及CSF中的成分可抑制大鼠中脑DA能神经元的功能及生长。采用立体定向技术将PD患者血IgG注入大鼠一侧黑质,黑质酪氨酸羟化酶(TH)及DA能神经元明显减少,提示可能有免疫介导性黑质细胞损伤。许多环境因素如MPTP、鱼藤酮、百草枯、铁剂等诱导的DA能神经元变性与小胶质细胞激活有关,小胶质细胞是脑组织主要的免疫细胞,在神经变性疾病发生中小胶质细胞不仅是简单的“反应性增生”,而且参与了整个病理过程。小胶质细胞活化后可通过产生氧自由基等促炎因子,对神经元产生毒性作用。DA能神经元对氧化应激十分敏感,而活化的小胶质细胞是氧自由基产生的主要来源。此外,中脑黑质是小胶质细胞分布最为密集的区域,决定了小胶质细胞的活化在帕金森病发生发展中有重要作用。5. 年龄因素 PD主要发生于中老年,40岁以前很少发病。研究发现自30岁后黑质DA能神经元、酪氨酸羟化酶(TH)和多巴脱羧酶(DDC)活力,以及纹状体DA递质逐年减少,DA的D1和D2受体密度减低。然而,罹患PD的老年人毕竟是少数,说明生理性DA能神经元退变不足以引起PD。只有黑质DA能神经元减少50%以上,纹状体DA递质减少80%以上,临床才会出现PD症状,老龄只是PD的促发因素。6. 泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)功能异常 UPS可选择性降低细胞内的蛋白质,在细胞周期性增殖及凋亡相关蛋白的降解中发挥重要作用。Parkin基因突变常导致UPS功能障碍,不能降解错误折叠的蛋白,错误折叠蛋白的过多异常聚集则对细胞有毒性作用,引起氧化应激增强和线粒体功能损伤。应用蛋白酶体抑制剂已经构建成模拟PD的细胞模型。7.兴奋性毒性作用 应用微透析及高压液相色谱(HPLC)检测发现,由MPTP制备的PD猴模型纹状体中兴奋性氨基酸(谷氨酸、天门冬氨酸)含量明显增高。若细胞外间隙谷氨酸浓度异常增高,过度刺激受体可对CNS产生明显毒性作用。动物实验发现,脑内注射微量谷氨酸可导致大片神经元坏死,谷氨酸兴奋性神经毒作用是通过N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)介导的,与DA能神经元变性有关。谷氨酸可通过激活NMDA受体产生一氧化氮(NO)损伤神经细胞,并释放更多的兴奋性氨基酸,进一步加重神经元损伤。8.细胞凋亡 PD发病过程存在细胞凋亡及神经营养因子缺乏等。细胞凋亡是帕金森病患者DA能神经元变性的基本形式,许多基因及其产物通过多种机制参与DA能神经元变性的凋亡过程。此外,多种迹象表明多巴胺转运体和囊泡转运体的异常表达与DA能神经元的变性直接相关。其他如神经细胞自噬、钙稳态失衡可能也参与帕金森病的发病。目前,大多数学者认同帕金森病并非单一因素引起,是由遗传、环境因素、免疫/炎性因素、线粒体功能衰竭、兴奋性氨基酸毒性、神经细胞自噬及老化等多种因素通过多种机制共同作用所致。【病理及生化病理】1.病理 PD主要病理改变是含色素神经元变性、缺失,黑质致密部DA能神经元最显著。镜下可见神经细胞减少,黑质细胞黑色素消失,黑色素颗粒游离散布于组织和巨噬细胞内,伴不同程度神经胶质增生。正常人黑质细胞随年龄增长而减少,黑质细胞80岁时从原有42.5万减至20万个,PD患者少于10万个,出现症状时DA能神经元丢失50%以上,蓝斑、中缝核、迷走神经背核、苍白球、壳核、尾状核及丘脑底核等也可见轻度改变。残留神经元胞浆中出现嗜酸性包涵体路易小体(Lewy body)是本病重要的病理特点,Lewy小体是细胞质蛋白质组成的玻璃样团块,中央有致密核心,周围有细丝状晕圈。一个细胞有时可见多个大小不同的Lewy小体,见于约10%的残存细胞,黑质明显,苍白球、纹状体及蓝斑等亦可见,α-突触核蛋白和泛素是Lewy小体的重要组分。α-突触核蛋白在许多脑区含量丰富,多集中于神经元突触前末梢。在小鼠或果蝇体内过量表达α-突触核蛋白可产生典型的帕金森病症状。尽管α-突触核蛋白基因突变仅出现在小部分家族性帕金森病患者中,但该基因表达的蛋白是路易小体的主要成分,提示它在帕金森病发病过程中起重要作用。2.生化病理 PD最显著的生物化学特征是脑内DA含量减少。DA和乙酰胆碱(ACh)作为纹状体两种重要神经递质,功能相互拮抗,两者平衡对基底核环路活动起重要的调节作用。脑内DA递质通路主要为黑质-纹状体系,黑质致密部DA能神经元自血流摄入左旋酪氨酸,在细胞内酪氨酸羟化酶(TH)作用下形成左旋多巴(L-dopa)→经多巴胺脱羧酶(DDC)→DA→通过黑质-纹状体束,DA作用于壳核、尾状核突触后神经元,最后被分解成高香草酸(HVA)。由于特发性帕金森病TH和DDC减少,使DA生成减少。单胺氧化酶B ( MAO-B)抑制剂减少神经元内DA分解代谢,增加脑内DA含量。儿茶酚-氧位-甲基转移酶(COMT)抑制剂减少L-dopa外周代谢,维持L-dopa稳定血浆浓度(图3-11-2),可用于PD治疗。
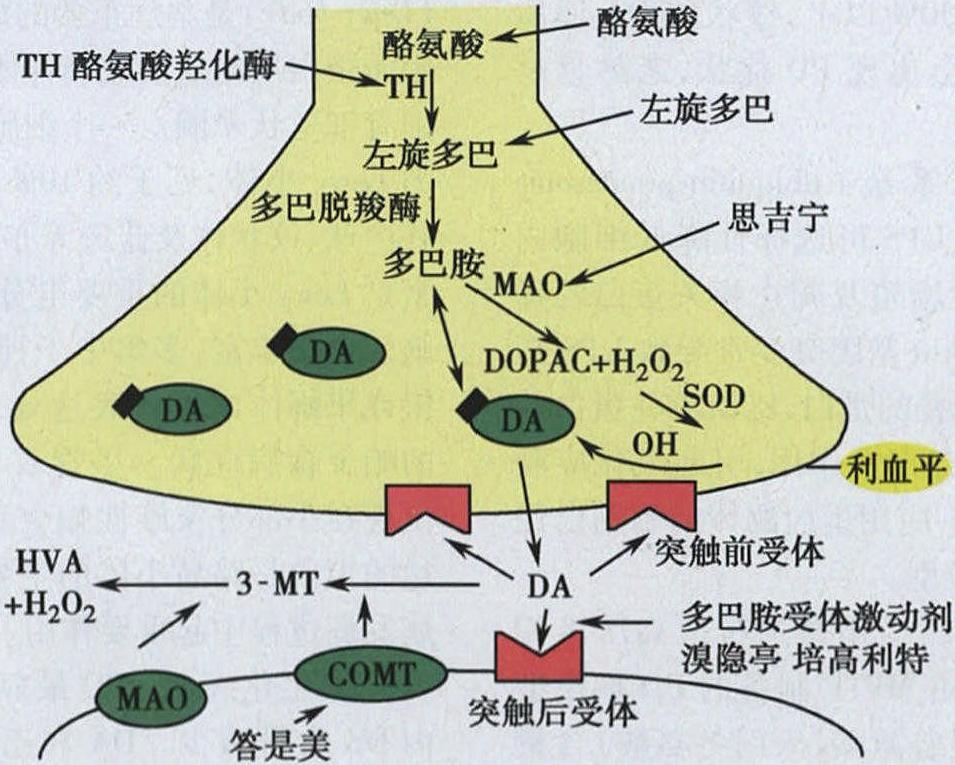 图3-11-2 多巴胺的合成和代谢PD患者黑质DA能神经元变性丢失,黑质-纹状体DA通路变性,纹状体DA含量显著降低(>80%),使ACh系统功能相对亢进,是导致肌张力增高、动作减少等运动症状的生化基础。此外,中脑-边缘系统和中脑-皮质系统DA含量亦显著减少,可能导致智能减退、行为情感异常、言语错乱等高级神经活动障碍。DA递质减少程度与患者症状严重度一致,病变早期通过DA更新率增加(突触前代偿)和DA受体失神经后超敏现象(突触后代偿),临床症状可能不明显(代偿期),随疾病的进展可出现典型PD症状(失代偿期)。基底核其他递质或神经肽如去甲肾上腺素(NE)、5-羟色胺(5-HT)、P物质(SP)、脑啡肽(ENK)、生长抑素(SS)等也有变化。
图3-11-2 多巴胺的合成和代谢PD患者黑质DA能神经元变性丢失,黑质-纹状体DA通路变性,纹状体DA含量显著降低(>80%),使ACh系统功能相对亢进,是导致肌张力增高、动作减少等运动症状的生化基础。此外,中脑-边缘系统和中脑-皮质系统DA含量亦显著减少,可能导致智能减退、行为情感异常、言语错乱等高级神经活动障碍。DA递质减少程度与患者症状严重度一致,病变早期通过DA更新率增加(突触前代偿)和DA受体失神经后超敏现象(突触后代偿),临床症状可能不明显(代偿期),随疾病的进展可出现典型PD症状(失代偿期)。基底核其他递质或神经肽如去甲肾上腺素(NE)、5-羟色胺(5-HT)、P物质(SP)、脑啡肽(ENK)、生长抑素(SS)等也有变化。 -
+临床表现
临床表现:帕金森病通常在40~70岁发病,60岁后发病率增高,在30多岁前发病者少见,男性略多。起病隐袭,发展缓慢,主要表现静止性震颤、肌张力增高、运动迟缓和姿势步态异常等,症状出现孰先孰后可因人而异。首发症状以震颤最多见(60%~70%),其次为步行障碍(12%)、肌强直(10%)和运动迟缓(10%)。症状常自一侧上肢开始,逐渐波及同侧下肢、对侧上肢与下肢,呈N字形的进展顺序(65%~70%);25%~30%的病例可自一侧的下肢开始,两侧下肢同时开始极少见,不少病例疾病晚期症状仍存在左右差异。1. 静止性震颤(static tremor) 常为PD的首发症状,多由一侧上肢远端(手指)开始,逐渐扩展到同侧下肢及对侧肢体,上肢震颤幅度较下肢明显,下颌、口唇、舌及头部常最后受累。典型表现静止性震颤,拇指与屈曲示指呈搓丸样(pill-rolling)动作,节律4 ~6Hz,静止时出现,精神紧张时加重,随意动作时减轻,睡眠时消失;常伴交替旋前与旋后、屈曲与伸展运动。令患者活动一侧肢体如握拳或松拳,可引起另侧肢体出现震颤,该试验有助于发现早期轻微震颤。少数患者尤其70岁以上发病者可能不出现震颤。部分患者可合并姿势性震颤。2.肌强直(rigidity) 锥体外系病变导致屈肌与伸肌张力同时增高,关节被动运动时始终保持阻力增高,似弯曲软铅管,称为铅管样强直(lead-pipe rigidity),如患者伴有震颤,检查者感觉在均匀阻力中出现断续停顿,如同转动齿轮,称为齿轮样强直(cogwheel rigidity),是肌强直与静止性震颤叠加所致。这两种强直与锥体束受损的折刀样强直不同,后者可伴腱反射亢进及病理征。以下的临床试验有助于发现轻微的肌强直:①令患者运动对侧肢体,被检肢体肌强直可更明显;②头坠落试验(head dropping test):患者仰卧位,快速撤离头下枕头时头常缓慢落下,而非迅速落下;③令患者把双肘置于桌上,使前臂与桌面成垂直位,两臂及腕部肌肉尽量放松,正常人此时腕关节与前臂约成90°屈曲,PD患者腕关节或多或少保持伸直,好像竖立的路标,称为“路标现象”。老年患者肌强直可能引起关节疼痛,是肌张力增高使关节血供受阻所致。3. 运动迟缓(bradykinesia) 表现为随意动作减少,包括始动困难和运动迟缓,因肌张力增高、姿势反射障碍出现一系列特征性运动障碍症状,如起床、翻身、步行和变换方向时运动迟缓,面部表情肌活动减少,常双眼凝视,瞬目减少,呈面具脸(masked face);以及手指精细动作如扣纽扣、系鞋带等困难,书写时字愈写愈小,称为写字过小征(micrographia)等。口、咽、腭肌运动障碍,使讲话缓慢,语音低沉单调,流涎等,严重时吞咽困难。4.姿势步态异常 患者四肢、躯干和颈部肌强直呈特殊屈曲体姿,头部前倾,躯干俯屈,上肢肘关节屈曲,腕关节伸直,前臂内收,指间关节伸直,拇指对掌。下肢髋关节与膝关节均略呈弯曲,随疾病进展姿势障碍加重,晚期自坐位、卧位起立困难。早期下肢拖曳,逐渐变为小步态,起步困难,起步后前冲,愈走愈快,不能及时停步或转弯,称慌张步态(festination),行走时上肢摆动减少或消失;因躯干僵硬,转弯时躯干与头部联带小步转弯,与姿势平衡障碍导致重心不稳有关。患者害怕跌倒,遇小障碍物也要停步不前。5. 非运动症状 PD的非运动症状包括疾病早期常出现的嗅觉减退、快动眼期睡眠行为障碍、便秘等症状。(1) 嗅觉缺失经常出现在运动症状前,是PD的早期特征,嗅觉检测作为一种可能的生物学标记物,有助于将来对PD高危人群的识别。(2) 抑郁症在PD患者中常见,约占患者的50%,多为疾病本身的表现,患者可能同时伴有5-羟色胺递质功能减低;通常应用5-羟色胺再摄取抑制剂,如舍曲林50mg、西酞普兰20mg等治疗可改善。运动症状好转常可使抑郁症状缓解。(3) 快动眼期睡眠行为障碍(RBD)可见于30%的PD患者,20%~38%的RBD患者可能发展为PD。与正常人相比,RBD患者存在明显的嗅觉障碍、颜色辨别力及运动速度受损。功能影像学显示特发性RBD患者纹状体内存在多巴胺转运体减少,RBD同样可能是PD的早期标志物,其确切的病理基础尚不清楚,可能与蓝斑下核及桥脚核等下位脑干病变有关。(4) 便秘是PD患者的常见症状,具有顽固性、反复性、波动性及难治性等特点。可能与肠系膜神经丛的神经元变性导致胆碱能功能降低,胃肠道蠕动减弱有关,此外,抗胆碱药等抗帕金森病药物可使蠕动功能下降,加重便秘。(5) 其他症状:诸如皮脂腺、汗腺分泌亢进引起脂颜(oily face)、多汗,交感神经功能障碍导致体位性低血压等;部分患者晚期出现轻度认知功能减退或痴呆、视幻觉等,通常不严重。
- +并发症
- +实验室检查
-
+其他辅助检查
其他辅助检查:(1) PD患者的CT、MRI检查通常无特征性异常。(2) 生化检测:高效液相色谱-电化学法(HPLC-EC)检测患者CSF和尿中高香草酸(HVA)含量降低,放免法检测CSF中生长抑素含量降低。血及脑脊液常规检查无异常。(3) 基因及生物标志物:家族性PD患者可采用DNA印迹技术(southern blot)、PCR、DNA序列分析等检测基因突变。采用蛋白组学等技术检测血清、CSF、唾液中α-突触核蛋白、DJ-1等潜在的早期PD生物学标志物。(4) 超声检查可见对侧中脑黑质的高回声(图3-11-3)。

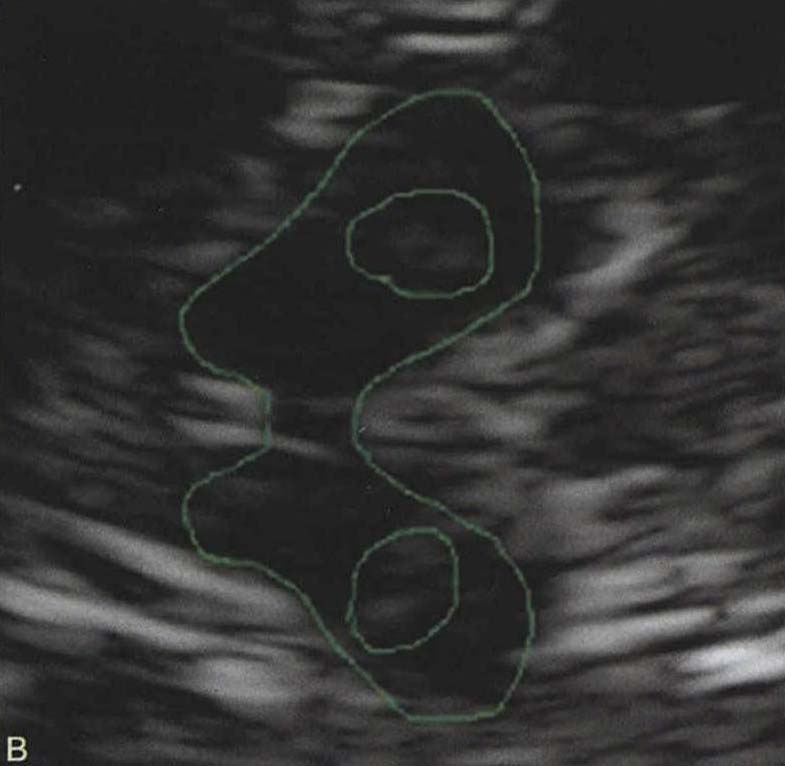 图3-11-3A.偏侧帕金森病对侧中脑黑质出现高回声;B.双侧帕金森病两侧中脑黑质出现高回声(5) 功能影像学检测:①DA受体功能显像:PD纹状体DA受体,主要是D2受体功能发生改变,PET和SPECT可动态观察DA受体,SPECT较简便经济,特异性D2受体标记物123碘Iodobenzamide(123IIBZM)合成使SPECT应用广泛;②DA转运体(dopamine transporter,DAT)功能显像:纹状体突触前膜DAT可调控突触间隙中DA有效浓度,使DA对突触前和突触后受体发生时间依赖性激动,早期PD患者DAT功能较正常下降31%~65%,应用123I-β-CIT PET或99mTc-TRODAT-1 SPECT可检测DAT功能,用于PD早期和亚临床诊断(图3-11-4);③神经递质功能显像:18F-dopa透过血-脑屏障入脑,多巴脱羧酶将18F-dopa转化为18F-DA,PD患者纹状体区18Fdopa放射性聚集较正常人明显减低,提示多巴脱羧酶活性降低。
图3-11-3A.偏侧帕金森病对侧中脑黑质出现高回声;B.双侧帕金森病两侧中脑黑质出现高回声(5) 功能影像学检测:①DA受体功能显像:PD纹状体DA受体,主要是D2受体功能发生改变,PET和SPECT可动态观察DA受体,SPECT较简便经济,特异性D2受体标记物123碘Iodobenzamide(123IIBZM)合成使SPECT应用广泛;②DA转运体(dopamine transporter,DAT)功能显像:纹状体突触前膜DAT可调控突触间隙中DA有效浓度,使DA对突触前和突触后受体发生时间依赖性激动,早期PD患者DAT功能较正常下降31%~65%,应用123I-β-CIT PET或99mTc-TRODAT-1 SPECT可检测DAT功能,用于PD早期和亚临床诊断(图3-11-4);③神经递质功能显像:18F-dopa透过血-脑屏障入脑,多巴脱羧酶将18F-dopa转化为18F-DA,PD患者纹状体区18Fdopa放射性聚集较正常人明显减低,提示多巴脱羧酶活性降低。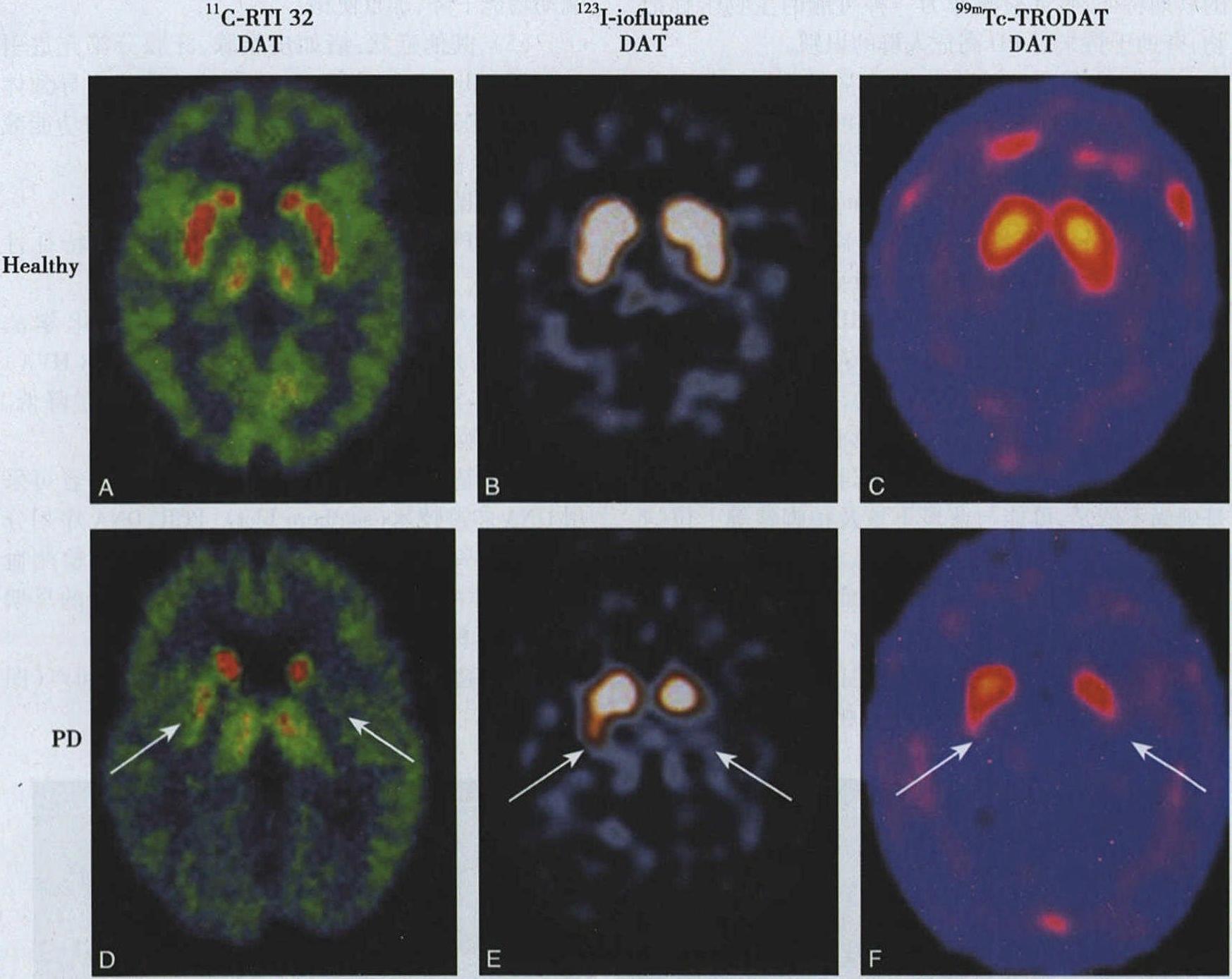 图3-11-4 脑功能影像显示帕金森病患者的纹状体区DAT活性降低(6) 药物试验:目前临床已很少采用。1) 左旋多巴试验(levodopa test):①试验前24小时停用左旋多巴、多巴胺受体激动剂、抗胆碱能药、抗组胺药;②试验前30分钟和试验开始前各进行1次临床评分;③早8~9时患者排尿便,然后口服375~500mg多巴丝肼;④服药45~150分钟按UPDRS-Ⅲ量表测试患者的运动功能;⑤病情减轻为阳性反应。2) 多巴丝肼弥散剂(levodopa and benserazide)试验:药物吸收快,很快达到有效浓度,代谢快,用药量较小,可短时间(10~30分钟)内确定患者对左旋多巴反应。对PD诊断、鉴别诊断及药物选择等有价值。3) 阿扑吗啡试验(apomorphine test):①②项同左旋多巴试验;③皮下注射阿扑吗啡2mg;④用药后30~120分钟,测试患者的运动功能,病情减轻为阳性反应,如阴性可分别隔4小时用3mg、5mg或10mg阿扑吗啡重复试验。
图3-11-4 脑功能影像显示帕金森病患者的纹状体区DAT活性降低(6) 药物试验:目前临床已很少采用。1) 左旋多巴试验(levodopa test):①试验前24小时停用左旋多巴、多巴胺受体激动剂、抗胆碱能药、抗组胺药;②试验前30分钟和试验开始前各进行1次临床评分;③早8~9时患者排尿便,然后口服375~500mg多巴丝肼;④服药45~150分钟按UPDRS-Ⅲ量表测试患者的运动功能;⑤病情减轻为阳性反应。2) 多巴丝肼弥散剂(levodopa and benserazide)试验:药物吸收快,很快达到有效浓度,代谢快,用药量较小,可短时间(10~30分钟)内确定患者对左旋多巴反应。对PD诊断、鉴别诊断及药物选择等有价值。3) 阿扑吗啡试验(apomorphine test):①②项同左旋多巴试验;③皮下注射阿扑吗啡2mg;④用药后30~120分钟,测试患者的运动功能,病情减轻为阳性反应,如阴性可分别隔4小时用3mg、5mg或10mg阿扑吗啡重复试验。 -
+诊断
诊断:英国帕金森病协会脑库(UKPDBB)诊断标准以及中国帕金森病诊断标准均依据中老年发病,缓慢进展性病程,必备运动迟缓及至少具备静止性震颤、肌强直或姿势步态障碍中的一项,结合对左旋多巴治疗敏感即可作出临床诊断(表3-11-1)。联合嗅觉、经颅多普勒超声及功能影像(PET/SPECT)检查有助于早期发现临床前帕金森病。帕金森病的临床与病理诊断符合率约为80%。表3-11-1 英国PD协会脑库(UKPDBB) 临床诊断标准
包括标准 排除标准 支持标准 ·运动迟缓(随意运动启动缓 ·反复卒中病史,伴随阶梯形进展的 确诊PD需具备以下3个或 ·并至少具备以下中的一项:肌 ·明确的脑炎病史 ·静止性震颤 - +鉴别诊断
鉴别诊断:PD主要须与其他原因引起的帕金森综合征鉴别(表3-11-2)。在所有帕金森综合征中,约75%为原发性帕金森病,约25%为其他原因引起的帕金森综合征。表3-11-2 帕金森病与帕金森综合征的分类1.原发性 (1) 继发性帕金森综合征:有明确的病因可寻,如感染、药物、中毒、脑动脉硬化、创伤等。继发于甲型脑炎(即昏睡性脑炎)后的帕金森综合征,目前已罕见。多种药物均可导致药物性帕金森综合征,一般是可逆的。在拳击手中偶见头部创伤引起的帕金森综合征。老年人基底核区多发性腔隙性梗死可引起血管性帕金森综合征,患者有高血压、动脉硬化及卒中史,步态障碍较明显,震颤少见,常伴锥体束征。(2) 伴发于其他神经变性疾病的帕金森综合征:不少神经变性疾病具有帕金森综合征表现。这些神经变性疾病各有其特点,有些为遗传性,有些为散发的,除程度不一的帕金森症状外,还有其他症状,如不自主运动、垂直性眼球凝视障碍(见于进行性核上性麻痹)、体位性低血压(Shy-Drager综合征)、小脑性共济失调(橄榄脑桥小脑萎缩)、出现较早且严重的痴呆(路易体痴呆)、角膜色素环(肝豆状核变性)、皮质复合感觉缺失、锥体束征和失用、失语(皮质基底核变性)等。此外,所伴发的帕金森病症状,经常以强直、少动为主,静止性震颤很少见,对左旋多巴治疗不敏感。(3) 早期患者须与原发性震颤、抑郁症、脑血管病鉴别:①原发性震颤较常见,约1/3的患者有家族史,在各年龄期均可发病,姿势性或动作性震颤为唯一的表现,无肌强直和运动迟缓,饮酒或用普萘洛而后震颤可显著减轻;②抑郁症可伴表情贫乏、言语单调、随意运动减少,但无肌强直和震颤,抗抑郁剂治疗有效;③早期帕金森病症状限于一侧肢体,患者常主诉一侧肢体无力或不灵活,若无震颤,易误诊为脑血管病,询问原发病和仔细体检易于鉴别。- +治疗
治疗:帕金森病的治疗原则是,采取综合治疗,包括药物治疗、手术治疗、康复治疗、心理治疗等,目前应用的所有治疗手段,只能改善症状,不能阻止病情发展。其中药物治疗是首选的主要的治疗手段。【药物治疗】1. 药物治疗原则 应从小剂量开始,缓慢递增,以较小剂量达到较满意的疗效。治疗应考虑个体化特点,用药选择不仅要考虑病情特点,而且要考虑患者的年龄、就业状况、经济承受能力等因素。药物治疗目标是延缓疾病进展、控制症状,并尽可能延长症状控制的年限,同时尽量减少药物副作用和并发症。2.保护性治疗 目的是延缓疾病发展,改善患者症状。原则上,帕金森病一旦被诊断就应及早进行保护性治疗。目前临床应用的保护性治疗药物主要是单胺氧化酶B型(MAO-B)抑制剂。曾报道司来吉兰+维生素E疗法(deprenyl and tocopherol antioxidation therapy of parkinsonism,DATATOP)可推迟使用左旋多巴、延缓疾病发展约9个月,可用于早期轻症PD患者;但司来吉兰的神经保护作用仍未定论。多巴胺受体激动剂和辅酶Q10也可能有神经保护作用。3.症状性治疗 选择药物的原则是:(1) 老年前期(<65岁)患者,且不伴智能减退,可以选择:①多巴胺受体激动剂;②MAO-B抑制剂司来吉兰,或加用维生素E;③复方左旋多巴+儿茶酚-氧位-甲基转移酶(COMT)抑制剂;④金刚烷胺和(或)抗胆碱能药:震颤明显而其他抗帕金森病药物效果不佳时,可试用抗胆碱能药;⑤复方左旋多巴:一般在①、②、④方案治疗效果不佳时加用。在某些患者,如果出现认知功能减退,或因特殊工作之需,需要显著改善运动症状,复方左旋多巴也可作为首选。(2) 老年期(≥65岁)患者或伴智能减退:首选复方左旋多巴,必要时可加用多巴胺受体激动剂、MAO-B抑制剂或COMT抑制剂。尽可能不用苯海索,尤其老年男性患者,除非有严重震颤,并明显影响患者的日常生活或工作能力时。4. 治疗药物(1) 抗胆碱能药(anticholinergicagent):抑制ACh的活力,可提高脑内DA的效应和调整纹状体内的递质平衡,临床常用盐酸苯海索(安坦,artane)。对震颤和强直有效,对运动迟缓疗效较差,适于震颤明显年龄较轻的患者。常用1~2mg口服,每天3次。该药改善症状短期效果较明显,但常见口干、便秘和视物模糊等不良反应,偶可见神经精神症状。闭角型青光眼及前列腺肥大患者禁用。中国指南建议苯海索由于有较多的不良反应,尽可能不用,尤其老年男性患者。(2) 金刚烷胺(amantadine):促进神经末梢DA释放,阻止再摄取,可轻度改善少动、强直和震颤等。起始剂量50mg,每天2~3次,1周后增至100mg,每天2~3次,一般不超过300mg/d,老年人不超过200mg/d。药效可维持数月至一年。副作用较少,如不安、意识模糊、下肢网状青斑、踝部水肿和心律失常等,肾功能不全、癫痫、严重胃溃疡和肝病患者慎用,哺乳期妇女禁用。(3) 左旋多巴(L-dopa)及复方左旋多巴:PD患者迟早要用到L-dopa治疗。L-dopa可透过血-脑屏障,被脑DA能神经元摄取后脱羧变为DA,改善症状,对震颤、强直、运动迟缓等运动症状均有效。由于95%以上的L-dopa在外周脱羧成为DA,仅约1%通过血-脑屏障进入脑内,为减少外周副作用,增强疗效,多用L-dopa与外周多巴脱羧酶抑制剂(DCI)按4:1制成的复方左旋多巴制剂,用量较L-dopa减少3/4。1) 复方左旋多巴剂型:包括标准片、控释片、水溶片等。● 标准片:多巴丝肼(Madopar)由L-dopa与苄丝肼按4:1组成,多巴丝肼250为L-dopa 200mg加苄丝肼50mg,多巴丝肼125为L-dopa100mg加苄丝肼25mg;国产多巴丝肼胶囊成分与多巴丝肼相同。息宁(Sinemet) 250和Sinemet 125是由L-dopa与卡比多巴按4:1组成。● 控释片:有多巴丝肼液体动力平衡系统(madoparHBS)和息宁控释片(sinemet CR)。多巴丝肼-HBS:剂量为125mg,由L-dopa100mg加苄丝肼25mg及适量特殊赋形剂组成。口服后药物在胃内停留时间较长,药物基质表面先形成水化层,通过弥散作用逐渐释放,在小肠pH较高的环境中逐渐被吸收。多种因素可影响药物的吸收,如药物溶解度、胃液与肠液的pH、胃排空时间等。本品不应与制酸药同时服用。息宁控释片(sinemet CR):L-dopa 200mg加卡比多巴50mg,制剂中加用单层分子基质结构,药物不断溶释,达到缓释效果,口服后120~150分钟达到血浆峰值浓度;片中间有刻痕,可分为半片服用。● 水溶片:弥散型多巴丝肼(madopar dispersible),剂量为125mg,由L-dopa 100mg加苄丝肼25mg组成。其特点是易在水中溶解,吸收迅速,很快达到治疗阈值浓度。2) 用药时机:何时开始复方左旋多巴治疗尚有争议,长期用药会产生疗效减退、症状波动及异动症等运动并发症。一般应根据患者年龄、工作性质、症状类型等决定用药。年轻患者可适当推迟使用,患者因职业要求不得不用L-dopa时应与其他药物合用,减少复方左旋多巴剂量。年老患者可早期选用L-dopa,因发生运动并发症机会较少,对合并用药耐受性差。3) 用药方法:从小剂量开始,根据病情逐渐增量,用最低有效量维持。①标准片:复方左旋多巴开始用62.5mg(1/4片),每天2~4次,根据需要逐渐增至125mg,每天3~4次;最大剂量一般不超过250mg,每天3~4次;空腹(餐前1小时或餐后2小时)用药疗效好;②控释片:优点是减少服药次数,有效血药浓度稳定,作用时间长,可控制症状波动;缺点是生物利用度较低,起效缓慢,标准片转换成为控释片时每日剂量应相应增加并提前服用;适于症状波动或早期轻症患者;③水溶片:易在水中溶解,吸收迅速,10分钟起效,作用维持时间与标准片相同,该剂型适用于有吞咽障碍或置鼻饲管、清晨运动不能、“开-关”现象和剂末肌张力障碍患者。4) 运动并发症及其他药物副作用:主要有周围性和中枢性两类,前者为恶心、呕吐、低血压、心律失常(偶见);后者有症状波动、异动症和精神症状等。前者的副作用可以通过小剂量开始渐增剂量、餐后服药、加用多潘立酮等可避免或减轻上述症状。后者的副作用都在长期用药后发生,一般经过5年治疗后,约50%患者会出现症状波动或异动症等运动并发症。(4) DA受体激动剂:DA受体包括五种类型,D1受体和D2受体亚型与PD治疗关系密切。DA受体激动剂可:①直接刺激纹状体突触后DA受体,不依赖于多巴脱羧酶将L-dopa转化为DA发挥效应;②血浆半衰期(较复方左旋多巴)长;③推测可持续而非波动性刺激DA受体,预防或延迟运动并发症发生;PD早期单用DA受体激动剂有效,若与复方左旋多巴合用,可提高疗效,减少复方左旋多巴用量,且可减少或避免症状波动或异动症的发生。1) 适应证:PD后期患者用复方左旋多巴治疗产生症状波动或异动症,加用DA受体激动剂可减轻或消除症状,减少复方左旋多巴用量。疾病后期黑质纹状体DA能系统缺乏多巴脱羧酶,不能把外源性L-dopa脱羧转化为DA,用复方左旋多巴无效,用DA受体激动剂可能有效。发病年龄轻的早期患者可单独应用,应从小剂量开始,渐增量至获得满意疗效。副作用与复方左旋多巴相似,症状波动和异动症发生率低,体位性低血压和精神症状发生率较高。2) 该类药物有两种类型。麦角类和非麦角类。目前大多推荐非麦角类DA受体激动剂,尤其是年轻患者病程初期。这类长半衰期制剂能避免对纹状体突触后膜DA受体产生“脉冲”样刺激,从而预防或减少运动并发症的发生。麦角类DA受体激动剂可导致心脏瓣膜病和肺胸膜纤维化,多不主张使用。● 非麦角类:被美国神经病学学会、运动障碍学会,以及我国帕金森病治疗指南推荐为一线治疗药物。①普拉克索(Pramipexole):为新一代选择性D2、D3受体激动剂,开始0.125mg,每天3次,每周增加0.125mg,逐渐加量至0.5~1.0mg,每天3次,最大不超过4.5mg/d;服用左旋多巴的PD晚期患者加服普拉克索可改善左旋多巴不良反应,对震颤和抑郁有效;②罗匹尼罗(Ropinirole):用于早期或进展期PD,开始0. 25mg,每天3次,逐渐加量至2~4mg,每天3次,症状波动和异动症发生率低,常见意识模糊、幻觉及体位性低血压;③吡贝地尔(泰舒达缓释片):为缓释型选择性D2、D3受体激动剂,对中脑-皮质和边缘叶通路D3受体有激动效应,改善震颤作用明显,对强直和少动也有作用;初始剂量50mg,每天1次,第2周增至50mg,每天2次,有效剂量150mg/d,分3次口服,最大不超过250mg/d;④罗替戈汀(Rotigotine):为一种透皮贴剂,有4.5mg/10cm2,9mg/20cm2,13.5 mg/30cm2 ,18mg/40cm2等规格;早期使用4.5mg/10cm2,以后视病情发展及治疗反应可增大剂量,均每日1贴;治疗PD优势为可连续、持续释放药物,消除首关效应,提供稳态血药水平,避免对DA受体脉冲式刺激,减少口服药治疗突然“中断”状态,减少服左旋多巴等药物易引起运动波动、“开-关”现象等;⑤阿扑吗啡(apomorphine):为D1和D2受体激动剂,可显著减少“关期”状态,对症状波动,尤其“开-关”现象和肌张力障碍疗效明显,采取笔式注射法给药后5~15分钟起效,有效作用时间60分钟,每次给药0.5 ~2mg,每日可用多次,便携式微泵皮下持续灌注可使患者每日保持良好运动功能;也可经鼻腔给药。●麦角类:①溴隐亭(bromocriptine):D2受体激动剂,开始0.625mg/d,每隔3~5日增加0.625mg,通常治疗剂量7.5~15mg/d,分3次口服;副作用与左旋多巴类似,错觉和幻觉常见,精神病病史患者禁用,相对禁忌证包括近期心肌梗死、严重周围血管病和活动性消化性溃疡等;②α-二氢麦角隐亭(dihydro-α-ergocryptine):2.5mg,每天2次,每隔5天增加2.5mg,有效剂量30~50mg/d,分3次口服。上述四种药物之间的参考剂量转换为:吡贝地尔:普拉克索:溴隐亭:α-二氢麦角隐亭为100:1:10:60;③卡麦角林(cabergoline):是所有DA受体激动剂中半衰期最长(70小时),作用时间最长,适于PD后期长期应用复方左旋多巴产生症状波动和异动症患者,有效剂量2~10mg/d,平均4mg/d,只需每天1次,较方便;④利舒脲(lisuride):具有较强的选择性D2受体激动作用,对D1受体作用很弱。按作用剂量比,其作用较溴隐亭强10~20倍,但作用时间短于溴隐亭;其t1/2短(平均2.2小时),该药为水溶性,可静脉或皮下输注泵应用,主要用于因复方左旋多巴治疗出现明显的“开-关”现象者;治疗须从小剂量开始,0.05~0.1mg/d,逐渐增量,平均有效剂量为2.4~4.8mg/d。(5) 单胺氧化酶B (MAO-B)抑制剂:抑制神经元内DA分解,增加脑内DA含量。合用复方左旋多巴有协同作用,减少L-dopa约1/4用量,延缓“开-关”现象。MAO-B抑制剂中的司来吉兰(selegiline)即丙炔苯丙胺(deprenyl) 2.5~5mg,每天2次,因可引起失眠,不宜傍晚服用。副作用有口干、胃纳少和体位性低血压等,胃溃疡患者慎用。该药可与左旋多巴合用,亦可单独应用,可缓解PD症状,也可能有神经保护作用。第二代MAO-B抑制剂雷沙吉兰(rasagiline)已投入临床应用,其作用优于第一代司来吉兰5~10倍,对各期PD患者症状均有改善作用,也可能有神经保护作用;其代谢产物为一种无活性非苯丙胺物质Aminoindan,安全性较第一代MAOB抑制剂好。唑尼沙胺(zonisamide)原为抗癫痫药,偶然发现应用唑尼沙胺300mg/d有效控制癫痫的同时,也显著改善PD症状,抗PD机制证实为抑制MAO-B活性。(6) 儿茶酚-氧位-甲基转移酶(COMT)抑制剂:COMT是由脑胶质细胞分泌参与DA分解酶之一。COMT抑制剂通过抑制脑内、脑外COMT活性,提高左旋多巴生物利用度,显著改善左旋多巴疗效。COMT抑制剂本身不会对CNS产生影响,在外周主要阻止左旋多巴被COMT催化降解成3-氧甲基多巴。须与复方左旋多巴合用,单独使用无效,用药次数一般与复方左旋多巴次数相同。主要用于中晚期PD患者的剂末现象、“开-关”现象等症状波动的治疗,可使“关”期时限缩短,“开”期时限增加,也推荐用于早期PD患者初始治疗,希望通过持续DA能刺激(CDS),以推迟出现症状波动等运动并发症,但尚有待进一步研究证实。①恩他卡朋(entacapone):亦名珂丹(comtan),是周围COMT抑制剂,100 ~200mg口服;可提高CNS对血浆左旋多巴利用,提高血药浓度,增强左旋多巴疗效,减少临床用量;该药耐受性良好,主要不良反应是胃肠道症状,尿色变浅,但无严重肝功能损害报道;②托卡朋(tolcapone):亦名答是美(tasmar),100 ~200mg口服;该药是治疗PD安全有效的辅助药物,副作用有腹泻、意识模糊、转氨酶升高,偶有急性重症肝炎报道,应注意肝脏毒副作用,用药期间须监测肝功能。(7) 腺苷A2A受体阻断剂:腺苷A2A受体在基底核选择性表达,与运动行为有关。多项证据表明,阻断腺苷A2A受体能够减轻DA能神经元的退变。伊曲茶碱( istradefylline)是一种新型腺苷A2A受体阻断剂,可明显延长PD患者“开期”症状,缩短“关期”,具有良好安全性和耐受性,临床上已用于PD治疗。5. 治疗策略(1) 早期帕金森病治疗(Hoehn&Yahr Ⅰ ~ Ⅱ级):疾病早期若病情未对患者造成心理或生理影响,应鼓励患者坚持工作,参与社会活动和医学体疗(关节活动、步行、平衡及语言锻炼、面部表情肌操练、太极拳等),可暂缓用药。若疾病影响患者的日常生活和工作能力,应开始症状性治疗。(2) 中期帕金森病治疗(Hoehn&Yahr Ⅲ级):若在早期阶段首选DA受体激动剂、司来吉兰或金刚烷胺/抗胆碱能药治疗的患者,发展至中期阶段时症状改善往往已不明显,此时应添加复方左旋多巴治疗;若在早期阶段首选小剂量复方左旋多巴治疗患者,应适当增加剂量,或添加DA受体激动剂、司来吉兰或金刚烷胺,或COMT抑制剂。(3) 晚期帕金森病治疗(Hoehn&Yahr Ⅳ~Ⅴ级):晚期帕金森病临床表现极复杂,包括疾病本身进展,也有药物副作用因素。晚期患者治疗,一方面继续力求改善运动症状,另一方面需处理伴发的运动并发症和非运动症状。6.运动并发症治疗 运动并发症,如症状波动和异动症是晚期PD患者治疗中最棘手的问题,包括药物剂量、用法等治疗方案调整及手术治疗(主要是脑深部电刺激术)。(1) 症状波动的治疗:症状波动(motor fluctuation)有两种形式:①疗效减退(wearing-off)或剂末恶化(end of dose deterioration):指每次用药的有效作用时间缩短,症状随血液药物浓度发生规律性波动,可增加每日服药次数或增加每次服药剂量或改用缓释剂,也可加用其他辅助药物;②“开-关”现象(onoff phenomenon):指症状在突然缓解(“开期”)与加重(“关期”)之间波动,开期常伴异动症;多见于病情严重者,发生机制不详,与服药时间、血浆药物浓度无关;处理困难,可试用DA受体激动剂;③冻结现象(freezing phenomenon):患者行动踌躇,可发生于任何动作,突出表现是步态冻结(gait freezing),推测是情绪激动使细胞过度活动,增加去甲肾上腺素能介质输出所致;如冻结现象发生在复方左旋多巴剂末期,伴PD其他体征,增加复方左旋多巴单次剂量可使症状改善;如发生在“开期”,减少复方左旋多巴剂量,加用MAO-B抑制剂或DA受体激动剂或许有效,部分患者经过特殊技巧训练也可改善。(2) 异动症的治疗:异动症(abnormal involuntary movements,AIMs)又称为运动障碍(dyskinesia),常表现舞蹈-手足徐动症样、肌张力障碍样动作,可累及头面部、四肢及躯干。异动症常见的三种形式是:①剂峰异动症(peak-dose dyskinesia)或改善-异动症-改善(improvement-dyskinesia-improvement,I-D-I):常出现在血药浓度高峰期(用药1~2小时),与用药过量或DA受体超敏有关,减少复方左旋多巴单次剂量可减轻异动症,晚期患者治疗窗较窄,减少剂量虽有利于控制异动症,但患者往往不能进入“开期”,故减少复方左旋多巴剂量时需加用DA受体激动剂;②双相异动症(biphasic dyskinesia)或异动症-改善-异动症(dyskinesia-improvement-dyskinesia,D-I-D):剂峰和剂末均可出现,机制不清,治疗困难,可尝试增加复方左旋多巴每次剂量或服药次数,或加用DA受体激动剂;③肌张力障碍(dystonia):常表现足或小腿痛性痉挛,多发生于清晨服药前,可睡前服用复方左旋多巴控释剂或长效DA受体激动剂,或起床前服用弥散型多巴丝肼或标准片;发生于剂末或剂峰的肌张力障碍可相应增减复方左旋多巴用量。不常见的异动症也有三种形式:①反常动作(kinesia paradoxica):可能由于情绪激动使神经细胞产生或释放DA引起少动现象短暂性消失;②少动危象(akinetic crisis):患者较长时间不能动,与情绪改变无关,是PD严重的少动类型,可能由于纹状体DA释放耗竭所致;③出没现象(yo-yoing):表现出没无常的少动,与服药时间无关。7. 非运动症状的治疗 帕金森病的非运动症状主要包括精神障碍、自主神经功能紊乱、感觉障碍等。(1) 精神障碍的治疗:PD患者的精神症状表现形式多种多样,如生动梦境、抑郁、焦虑、错觉、幻觉、欣快、轻躁狂、精神错乱及意识模糊等。治疗原则是:首先考虑依次逐减或停用抗胆碱能药、金刚烷胺、DA受体激动剂、司来吉兰等抗帕金森病药物;若采取以上措施患者仍有症状,可将复方左旋多巴逐步减量;经药物调整无效的严重幻觉、精神错乱、意识模糊可加用非经典抗精神病药如氯氮平、喹硫平;氯氮平(clozapine)被B级推荐,可减轻意识模糊和精神障碍,不阻断DA能药效,可改善异动症,但需定期监测粒细胞;喹硫平(quetiapine)被C级推荐,不影响粒细胞数;奥氮平(olanzapine)不推荐用于PD精神症状治疗(B级推荐)。抑郁、焦虑、痴呆等可为疾病本身表现,用药不当可能加重。精神症状常随运动症状波动,“关期”出现抑郁、焦虑,“开期”伴欣快、轻躁狂,改善运动症状常使这些症状缓解。较重的抑郁症、焦虑症可用5-羟色胺再摄取抑制剂。对认知障碍和痴呆可应用胆碱酯酶抑制剂,如石杉碱甲、多奈哌齐(donepezil)、利斯的明(rivastigmine)或加兰他敏(galantamine)。(2) 自主神经功能障碍治疗:自主神经功能障碍常见便秘、排尿障碍及体位性低血压等。便秘增加饮水量和高纤维含量食物对大部分患者有效,停用抗胆碱能药,必要时应用通便剂;排尿障碍患者需减少晚餐后摄水量,可试用奥昔布宁、莨菪碱等外周抗胆碱能药;体位性低血压患者应增加盐和水摄入量,睡眠时抬高头位,穿弹力裤,从卧位站起宜缓慢,α-肾上腺素能激动剂米多君治疗有效。(3) 睡眠障碍:较常见,主要为失眠和快速眼动期睡眠行为异常(RBD),可应用镇静安眠药。失眠若与夜间帕金森病运动症状相关,睡前需加用复方左旋多巴控释片。若伴不宁腿综合征(RLS)睡前加用DA受体激动剂如普拉克索,或复方左旋多巴控释片。【手术及干细胞治疗】1. 中晚期PD患者常不可避免地出现药物疗效减退及严重并发症,通过系统的药物调整无法解决时可考虑选择性手术治疗。苍白球损毁术的远期疗效不尽如人意,可能有不可预测的并发症,临床已很少施行。目前,推荐深部脑刺激疗法(deep brain stimulation,DBS),优点是定位准确、损伤范围小、并发症少、安全性高和疗效持久等,缺点是费用昂贵。适应证为:①原发性帕金森病,病程5年以上;②服用复方左旋多巴曾有良好疗效,目前疗效明显下降或出现严重的运动波动或异动症,影响生活质量;③除外痴呆和严重的精神疾病。2.细胞移植将自体肾上腺髓质或异体胚胎中脑黑质细胞移植到患者纹状体,纠正DA递质缺乏,改善PD运动症状,目前已很少采用。酪氨酸羟化酶(TH)、神经营养因子,如胶质细胞源性神经营养因子(GNDF)和脑源性神经营养因子(BDNF)基因治疗,以及干细胞,包括骨髓基质干细胞、神经干细胞、胚胎干细胞和诱导性潜能干细胞移植治疗在动物实验中显示出良好疗效,已进行少数临床试验也显示一定的疗效。随着基因治疗的目的基因越来越多,基因治疗与干细胞移植联合应用可能是将来发展的方向。【中医、康复及心理治疗】中药或针灸和康复治疗作为辅助手段对改善症状也可起到一定作用。对患者进行语言、进食、走路及各种日常生活训练和指导,日常生活帮助如设在房间和卫生间的扶手、防滑橡胶桌垫、大把手餐具等,可改善生活质量。适当运动如打太极拳等对改善运动症状和非运动症状可有一定的帮助。教育与心理疏导也是PD治疗中不容忽视的辅助措施。- +预后
相关检查
- 知识库血清酪氨酸
- 知识库肾素活性
- 知识库脑脊液5-羟吲哚乙酸
- 知识库5-羟色胺
- +鉴别诊断
