您现在的位置:首页>缺铁性贫血
-
-概述
疾病概述:铁缺乏症(iron deficiency,ID)是体内长期铁负平衡的结果,最初引起体内贮存铁耗尽(iron depletion),继之红系细胞内发生缺铁,称为缺铁性红细胞生成(iron deficient erythropoiesis,IDE),最后才发生缺铁性贫血(iron deficiency anemia,IDA)。IDA是体内贮存铁缺乏影响血红素合成所引起的贫血,其特点是骨髓、肝、脾等器官组织中贮存铁减少,血清铁、运铁蛋白饱和度和血清铁蛋白降低,典型的呈小细胞低色素性贫血。它是一种综合征,并非一种疾病。铁缺乏症是最常见的营养素缺乏症,至今仍是世界各国普遍而重要的健康问题,尤其是发展中国家,其高危人群为妇女、婴幼儿和儿童。据全球187个国家1990年至2010年间疾病负担数据证实铁缺乏影响了20亿人。铁缺乏症的患病率为IDA的2倍。据复旦大学各附属医院流行病学调查,ID的患病率:6个月~2岁婴幼儿达75.0%~82.5%,育龄妇女为43.32%,妊娠3个月以上妇女为66. 27%,10~17岁青少年为13. 17%;以上人群IDA的患病率分别为33. 8%~45. 7%、11. 39%、19. 28%及9.84%。一、铁代谢(一) 铁稳态和铁分布 铁是人体最丰富的必需微量元素之一,所有具有功能的细胞均含有铁,它广泛参与机体内的代谢过程。缺铁可引起血红素合成障碍导致IDA,也会影响含铁酶包括线粒体中细胞色素酶系统的活力以及肌红蛋白的合成。同时,机体还必须防止游离铁的毒害作用,后者可促发产生大量自由基。因此,人体存在严格的铁代谢调节机制,可以确保体内铁始终处于正常生理水平,称机体的铁稳态(iron homeostasis)。人体铁代谢是在“封闭”系统内反复循环,铁重复被利用,衰老红细胞被巨噬细胞吞噬后,所释放的铁约80%以上被重新利用(图1)。除月经及上皮细胞脱落丢失铁外,人体无明显的生理性排泄铁,因此正常成年男性和绝经后妇女一般不会发生缺铁。
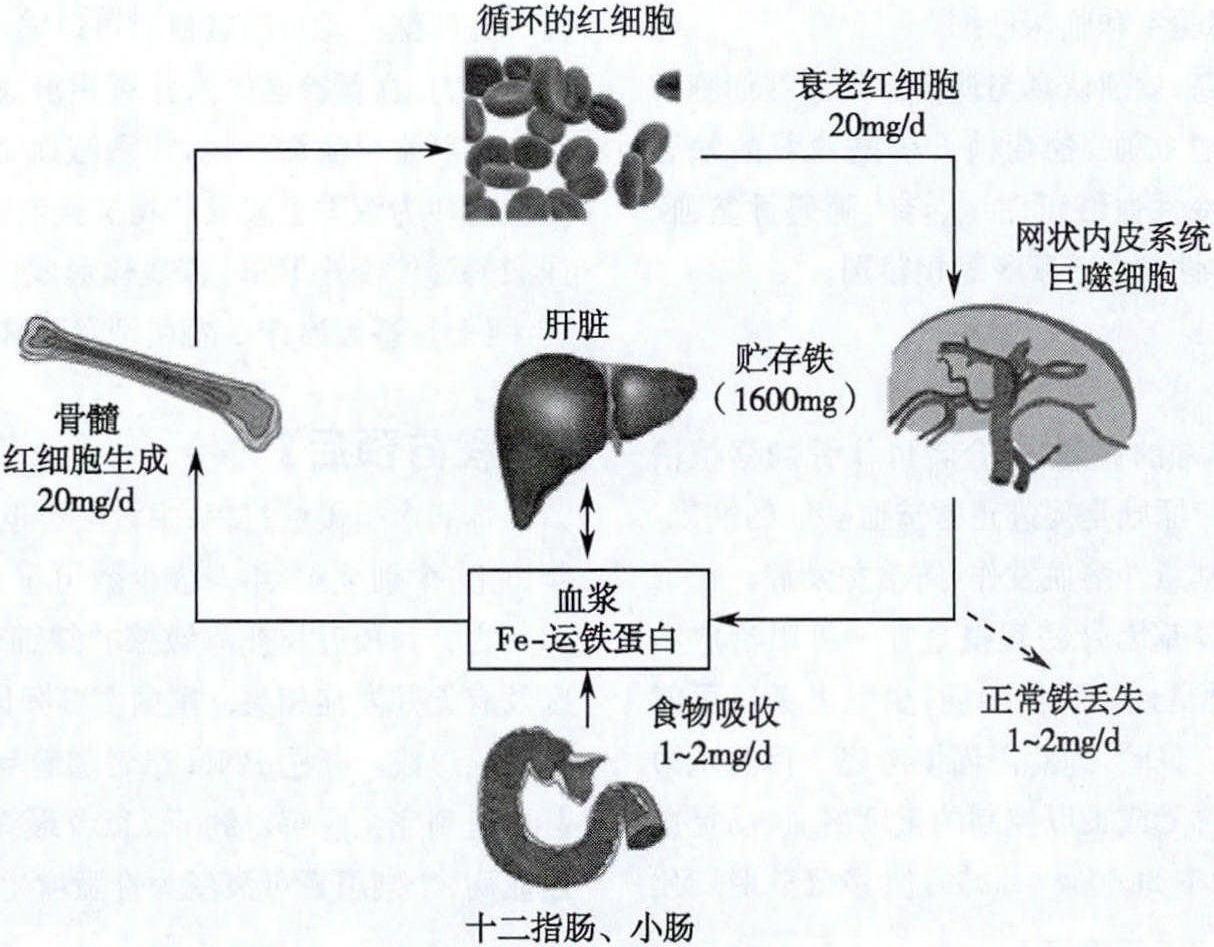 图1 正常人体铁稳态正常成人含铁总量男性为50mg/kg,女性为40mg/kg。铁的62.1%组成血红蛋白,4%在肌红蛋白,31%以铁蛋白和含铁血黄素的形式储存,0.3%存在于参加细胞代谢的血红素酶类,0.1%为血液中的转运铁,2.5%为短暂结合于细胞膜或细胞间蛋白的易变池铁。成年女性的储存铁较男性显著减少,容易发生IDA。(二)铁的吸收和转运 国人每日普通饮食中所供给的铁量为15~30mg,其中5%~10%被吸收,吸收量约1~2mg/d,主要吸收部位在十二指肠和空肠上段。铁的吸收形式有两种:①血红素铁,来自血红蛋白及动物食物的其他血红素蛋白,为二价铁,吸收率高。②非血红素铁,来自植物性食物中的高铁化合物等,为三价铁,必须转变为可溶性二价铁才易被吸收。胃酸可增加非血红素铁的溶解度,维生素C作为还原剂利于铁吸收。植物性食物中的磷酸盐、植酸盐、茶叶中的鞣酸及咖啡中的一些多酚类化合物等,都可与铁形成难以溶解的盐类而抑制非血红素铁的吸收,蛋黄中的磷蛋白和卵黄高磷蛋白和铁结合后可溶性差而不易吸收。因此铁的吸收率因食物种类而异,动物性食物约为20%~25%(蛋仅3%),植物性食物的吸收率<5%(但大豆为7%),人乳铁吸收率为50%,牛乳仅10%。食物中三价铁还原为二价铁后,在二价金属离子转运体1(DMT1)介导下进入肠上皮隐窝细胞,穿过上皮细胞的基底膜进入血流,转变为三价铁后与运铁蛋白(ferroportin)结合,转运到肝和各组织。运铁蛋白主要由肝合成,分子量为79 500的糖蛋白,1分子运铁蛋白有2个结合三价铁的位点。正常人运铁蛋白血浆浓度为2. 65~4. 30g/L,应用间接法测定,即为总铁结合力(total iron binding capacity,TIBC),即血浆中能与铁结合的球蛋白的总量。正常情况下仅以其总量的1/3与铁结合,这部分称血清铁,2/3未与铁结合的运铁蛋白称为未饱和的运铁蛋白(图2)。运铁蛋白饱和度=血清铁/总铁结合力×100%。
图1 正常人体铁稳态正常成人含铁总量男性为50mg/kg,女性为40mg/kg。铁的62.1%组成血红蛋白,4%在肌红蛋白,31%以铁蛋白和含铁血黄素的形式储存,0.3%存在于参加细胞代谢的血红素酶类,0.1%为血液中的转运铁,2.5%为短暂结合于细胞膜或细胞间蛋白的易变池铁。成年女性的储存铁较男性显著减少,容易发生IDA。(二)铁的吸收和转运 国人每日普通饮食中所供给的铁量为15~30mg,其中5%~10%被吸收,吸收量约1~2mg/d,主要吸收部位在十二指肠和空肠上段。铁的吸收形式有两种:①血红素铁,来自血红蛋白及动物食物的其他血红素蛋白,为二价铁,吸收率高。②非血红素铁,来自植物性食物中的高铁化合物等,为三价铁,必须转变为可溶性二价铁才易被吸收。胃酸可增加非血红素铁的溶解度,维生素C作为还原剂利于铁吸收。植物性食物中的磷酸盐、植酸盐、茶叶中的鞣酸及咖啡中的一些多酚类化合物等,都可与铁形成难以溶解的盐类而抑制非血红素铁的吸收,蛋黄中的磷蛋白和卵黄高磷蛋白和铁结合后可溶性差而不易吸收。因此铁的吸收率因食物种类而异,动物性食物约为20%~25%(蛋仅3%),植物性食物的吸收率<5%(但大豆为7%),人乳铁吸收率为50%,牛乳仅10%。食物中三价铁还原为二价铁后,在二价金属离子转运体1(DMT1)介导下进入肠上皮隐窝细胞,穿过上皮细胞的基底膜进入血流,转变为三价铁后与运铁蛋白(ferroportin)结合,转运到肝和各组织。运铁蛋白主要由肝合成,分子量为79 500的糖蛋白,1分子运铁蛋白有2个结合三价铁的位点。正常人运铁蛋白血浆浓度为2. 65~4. 30g/L,应用间接法测定,即为总铁结合力(total iron binding capacity,TIBC),即血浆中能与铁结合的球蛋白的总量。正常情况下仅以其总量的1/3与铁结合,这部分称血清铁,2/3未与铁结合的运铁蛋白称为未饱和的运铁蛋白(图2)。运铁蛋白饱和度=血清铁/总铁结合力×100%。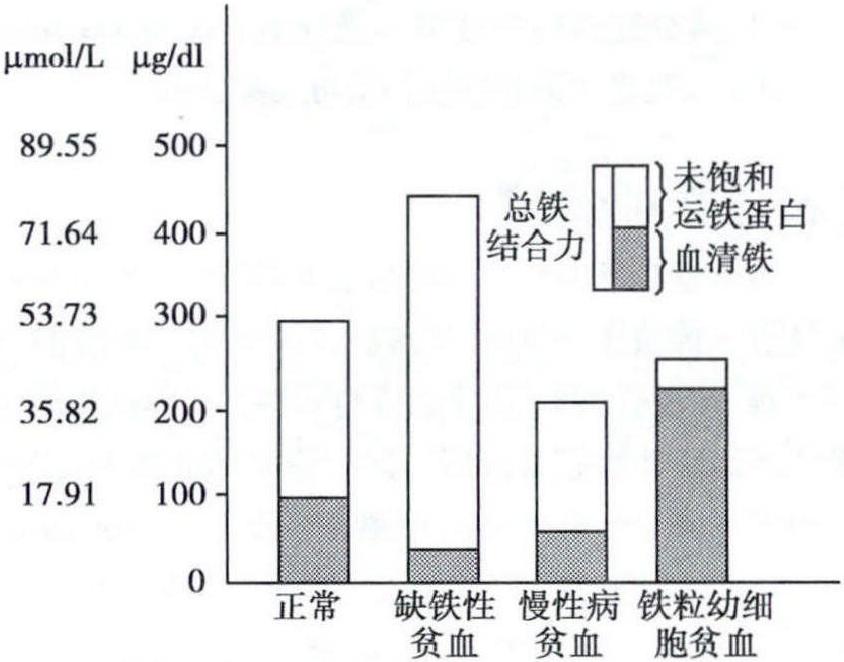 图2 各种疾病血清铁和总铁结合力的比较肝细胞膜上有两种运铁蛋白受体(tra nsferrin receptor,TfR): TfR1和TfR2。幼红细胞摄取运铁蛋白铁也需TfR,中幼红细胞TfR最多,受体可随细胞成熟而丢失。TfR是一种跨膜糖蛋白,铁被受体运送到幼红细胞内后,运铁蛋白和受体重新被运送到细胞表面,运铁蛋白被释放而重新被利用,铁被幼红细胞所摄取。进入幼红细胞的铁在线粒体上与原卟啉结合形成血红素,多余的铁以铁蛋白形式贮存于幼红细胞中。铁的储存形式有铁蛋白和含铁血黄素两种。铁粒幼细胞中的铁颗粒即为聚合的铁蛋白。含铁血黄素是变性或部分去蛋白质的铁蛋白聚合形成的不溶性含铁复合物,骨髓中可染铁即分布于骨髓小粒的含铁血黄素。(三) 铁代谢的调节 铁调素(hepcidin)是调节体内铁稳态的重要的铁调节激素,是由肝脏产生的含25个氨基酸的多肽,可调节小肠铁吸收、巨噬细胞铁再循环及肝铁的动用。铁调素是一种小肠铁吸收和巨噬细胞、肝细胞铁释放的负调控因子。在高铁状态、感染、炎症时产生增加,缺铁、组织释放缺氧信号时产生减少。铁缺乏时,铁调素转录受抑,促进肠道铁吸收和体内贮存铁释放。贫血缺氧时,低氧诱导因子2α (HIF-2α)增加,肾脏产生促红细胞生成素(EPO)增多,从而刺激红系造血。HIF-2α增加了肠上皮细胞顶端DMT1的表达,以增加膳食铁从肠道吸收入肠上皮细胞。铁调素水平下降,运铁蛋白不再分解,肠上皮细胞基底膜铁转运增加,巨噬细胞贮存铁转运至血液循环增多。肝细胞对铁的释放较巨噬细胞为慢。总之,在缺铁状态下,铁调素通过增加肠道铁吸收、增加巨噬细胞贮存铁和肝铁的释放和转运来调节铁代谢。十二指肠隐窝细胞可以感受体内铁变化,通过调节各种转运蛋白的表达量来控制铁的吸收。铁调节蛋白(IRP)可以通过调节TfR、运铁蛋白的合成水平来调节铁稳态。
图2 各种疾病血清铁和总铁结合力的比较肝细胞膜上有两种运铁蛋白受体(tra nsferrin receptor,TfR): TfR1和TfR2。幼红细胞摄取运铁蛋白铁也需TfR,中幼红细胞TfR最多,受体可随细胞成熟而丢失。TfR是一种跨膜糖蛋白,铁被受体运送到幼红细胞内后,运铁蛋白和受体重新被运送到细胞表面,运铁蛋白被释放而重新被利用,铁被幼红细胞所摄取。进入幼红细胞的铁在线粒体上与原卟啉结合形成血红素,多余的铁以铁蛋白形式贮存于幼红细胞中。铁的储存形式有铁蛋白和含铁血黄素两种。铁粒幼细胞中的铁颗粒即为聚合的铁蛋白。含铁血黄素是变性或部分去蛋白质的铁蛋白聚合形成的不溶性含铁复合物,骨髓中可染铁即分布于骨髓小粒的含铁血黄素。(三) 铁代谢的调节 铁调素(hepcidin)是调节体内铁稳态的重要的铁调节激素,是由肝脏产生的含25个氨基酸的多肽,可调节小肠铁吸收、巨噬细胞铁再循环及肝铁的动用。铁调素是一种小肠铁吸收和巨噬细胞、肝细胞铁释放的负调控因子。在高铁状态、感染、炎症时产生增加,缺铁、组织释放缺氧信号时产生减少。铁缺乏时,铁调素转录受抑,促进肠道铁吸收和体内贮存铁释放。贫血缺氧时,低氧诱导因子2α (HIF-2α)增加,肾脏产生促红细胞生成素(EPO)增多,从而刺激红系造血。HIF-2α增加了肠上皮细胞顶端DMT1的表达,以增加膳食铁从肠道吸收入肠上皮细胞。铁调素水平下降,运铁蛋白不再分解,肠上皮细胞基底膜铁转运增加,巨噬细胞贮存铁转运至血液循环增多。肝细胞对铁的释放较巨噬细胞为慢。总之,在缺铁状态下,铁调素通过增加肠道铁吸收、增加巨噬细胞贮存铁和肝铁的释放和转运来调节铁代谢。十二指肠隐窝细胞可以感受体内铁变化,通过调节各种转运蛋白的表达量来控制铁的吸收。铁调节蛋白(IRP)可以通过调节TfR、运铁蛋白的合成水平来调节铁稳态。 -
-预防
预防:应加强妇幼保健,预防早产,做好喂养指导,提倡母乳喂养,及时添加含铁量及铁吸收率高的辅食品。重视置节育环月经过多的问题。防治寄生虫病,特别是钩虫病。积极治疗慢性出血病灶。对早产儿、妊娠期妇女、胃切除者及反复献血者,应预防性口服铁剂。在高危人群也可推行铁强化食品。
- +流行病学
- +病因
- +发病机制
- +临床表现
- +并发症
- +实验室检查
- +其他辅助检查
- +诊断
- +鉴别诊断
- +治疗
