您现在的位置:首页>多囊卵巢综合征
-
+ 全部展开 -全部收缩
-
-概述
疾病概述:多囊卵巢综合征(polycystic ovary syndrome,PCOS)是常见的妇科内分泌疾病,以长期无排卵和高雄激素血症为基本特征,普遍存在胰岛素抵抗,临床表现异质性,约50%的PCOS病人超重或肥胖。
- -预防
-
+流行病学
流行病学:育龄妇女中PCOS的患病率是5%~10%,而在无排卵性不育症病人中的发病率高达30%~60%。近年来的研究发现该疾病的功能紊乱远超出生殖轴,由于存在胰岛素抵抗,常发展为2型糖尿病、脂代谢紊乱及心血管疾病等;且PCOS病人的代谢综合征的患病率为正常人群的4~11倍。
-
+病因
-
+发病机制
发病机制:PCOS病理生理的基本特征有:(1) 长期排卵功能障碍。(2) 雄激素过多。(3) 卵巢呈多囊样改变伴间质增生。(4) 胰岛素抵抗(insulin resistence,IR)。PCOS存在激素异常的交互影响,但始动因素至今尚未阐明。以下讨论PCOS病理生理机制及相互关系:1.雄激素过多症 正常女性循环中的雄激素有雄烯二酮、睾酮、脱氢表雄酮及硫酸脱氢表雄酮,主要来源于卵巢和肾上腺,少部分来源于腺外转化;PCOS病人的卵巢及肾上腺分泌的雄激素均增多,其机制如下:(1)肾上腺功能初现亢进:早在1980年Yen就提出了PCOS起于青春期的肾上腺功能初现(adrenarche)亢进,使肾上腺分泌的雄激素出现一过性增多,并导致垂体促性腺激素的脉冲分泌模式发生异常,致使卵巢继续分泌过多的雄激素。但关于PCOS肾上腺功能初现时雄激素分泌过多的机制尚不清楚,可能与肾上腺P450c17α酶系统活性增加有关。(2)促性腺激素分泌异常:PCOS病人垂体LH的合成量增加,其脉冲分泌的幅度和频率增加,使循环中黄体生成素(luteinizing hormone,LH)水平增高,而卵泡刺激素(follicle stimulating hormone,FSH)分泌正常或稍低于正常水平,从而使血中LH/FSH比值增加。过高的LH可促进卵巢内间质及卵泡膜细胞雄激素(包括睾酮和雄烯二酮)分泌过多;LH也可促进卵巢内IGF-Ⅰ的活性,而IGF-Ⅰ与卵巢内卵泡膜IGF-Ⅰ受体结合是促进卵巢雄激素产生的又一条途径。但关于PCOS促性腺激素LH分泌异常的机制,尚未完全阐明。早期的理论认为,过多的雄烯二酮在外周转化为雌酮,后者能促进LH的分泌。但是近年的研究发现,给予正常女性及PCOS病人外源性雌酮并没有增加基础状态下及GnRH刺激下的LH的分泌。另外,给予外周芳香化酶抑制剂阻断雄烯二酮向雌酮的转化,未发现LH的脉冲频率降低;因此目前的研究资料尚不足以证实雌酮能引起PCOS促性腺激素分泌异常的说法。最近有研究显示,过多的雄激素本身能干扰下丘脑-垂体-卵巢轴的正负反馈机制,促进垂体LH的释放,从而引起LH的异常升高;另外,也有研究显示LH过多的原因之一是由于垂体对LHRH(黄体生成素释放激素)的敏感性增加所致。因此,LH是促进PCOS卵巢分泌雄激素的主要激素之一;而过高的雄激素又可促进LH的释放,从而形成PCOS雄激素过多的恶性循环。(3)性激素结合球蛋白(sex hormone binding globin,SHBG):循环中的SHBG由肝脏产生,可与循环中的两种性激素即睾酮和雌二醇结合,从而调控这两种性激素的活性,只有不与SHBG结合的游离的性激素才具有生物活性。PCOS循环中升高的雄激素可抑制肝脏产生SHBG,从而降低循环中SHBG,继而使游离睾酮和游离雌二醇水平均增高。PCOS病人的高雄激素体征除了与雄激素产生过多有关,还与其活性形式——游离睾酮增加有关。因此,雄激素↑→SHBG↓→雄激素活性↑→SHBG↓ ↓→雄激素活性↑↑,是造成PCOS病人雄激素过多症及生物活性增加的又一恶性循环。(4)高胰岛素血症:早在1980年Burghen等就发现PCOS病人的循环中胰岛素水平增高,之后又相继出现类似报道,究其原因胰岛素水平升高是由胰岛素抵抗引起的。在病情早期PCOS病人胰岛B细胞通过分泌过多的胰岛素以克服IR,从而使PCOS病人血中的胰岛素水平升高,形成高胰岛素血症(hyperinsulinemia)。胰岛素是调节糖代谢的激素,也是卵巢行使正常功能的重要激素。但是过高的胰岛素对卵巢和肾上腺两个内分泌腺的雄激素分泌均具有促进作用,其机制是胰岛素对卵巢合成雄激素的酶(P450c17α酶系统)具有促进作用,并上调卵巢内卵泡膜细胞的LH受体,从而增强LH促进雄激素生成的作用。另外,胰岛素也可抑制肝脏SHBG的合成,从而使循环中SHBG进一步降低,导致游离睾酮的生物学活性进一步升高。(5)IGF-Ⅰ/IGFBPI系统:卵巢及循环中IGF-Ⅰ的活性受其结合蛋白(IGFBP-Ⅰ)的调节。PCOS病人卵巢中IGF-Ⅰ活性的增加不仅与循环中LH过度刺激有关,同时也与高胰岛素血症有关;胰岛素可通过上调卵巢IGF-Ⅰ受体数目而放大胰岛素自身及IGF-Ⅰ的作用。胰岛素还可通过抑制卵巢和肝脏产生IGFBP-Ⅰ,从而进一步导致卵巢局部和循环中游离IGF-Ⅰ的升高;这样,高胰岛素通过自身及IGF-Ⅰ的作用而促进雄激素分泌。目前的研究显示IGF-Ⅰ促进雄激素产生的可能机制包括:1)IGF-Ⅰ可以促进GnRH基因的表达,增加基础的和GnRH刺激的促性腺激素的释放。2)IGF-Ⅰ协同LH刺激雄激素的产生。3)由于IGF-Ⅰ/IGFBP比率降低,IGF-Ⅰ生物利用度升高,起到类促性腺激素的作用。4)促进雄激素合成关键酶细胞色素P45017酶mRNA和Ⅱ型3-β羟甾脱氢酶mRNA的表达,导致雄激素的合成增加。5)IGF-Ⅰ能增强外周5α-还原酶的活性,雄激素水平的升高也可以促进5α-还原酶活性,造成外周双氢睾酮(DHT)生成增加,从而加重高雄激素体征。2.卵巢多囊样改变 正常卵泡从始基卵泡自主发育到窦前卵泡,再到窦腔卵泡以及最后发育到成熟卵泡的过程中,经历初始募集、自主生长,调控生长,分化及最终成熟的4个阶段;期间经历2次募集,即始基卵泡自主发育的初始募集和窦腔卵泡在FSH作用下的周期性募集。PCOS病人初始募集阶段的卵泡较正常人群明显增多,约是正常者的6倍,而其卵泡进一步发育的周期性募集受到抑制。近来的研究发现雄激素在早期卵泡发育中起一定作用,过多的雄激素可刺激早期卵泡的生长,增加窦前卵泡及小窦状卵泡的发育,但是会抑制卵泡的周期募集和成熟。研究发现,超声下2~4mm卵泡数量增多与血清雄激素水平呈正相关。雄激素能加速始基卵泡自主发育,但抑制进一步发育的可能机制如下:①雄激素可通过增加卵泡内Bcl-2的表达,抑制Bax及p53的表达,从而抑制了卵泡的凋亡,使小卵泡数目增加;②雄激素可以降低卵泡内的生长分化因子9 (GDF-9)水平,增加循环中的LH,通过促进卵泡抑素、抗米勒管激素及前列腺组织生长因子的生成,而最终抑制卵泡的生长。另外,Durlinger等发现,敲除AMH小鼠卵巢的始基卵泡比正常小鼠的始基卵泡过早耗尽;因此,提出始基卵泡的初始发育受到AMH的抑制。免疫组化的证据显示,PCOS病人早期窦腔卵泡所产生的AMH显著低于正常排卵妇女;大量始基卵泡进入初期募集的多囊卵巢形态可能与缺少AMH对始基卵泡发育的抑制作用有关。3.胰岛素抵抗(IR) 研究表明,PCOS病人IR主要的机制是丝氨酸磷酸化异常增加,一方面胰岛素受体丝氨酸残基异常升高的磷酸化导致胰岛素信号通路受到抑制,进而出现葡萄糖代谢异常,导致IR;另一方面,雄激素合成酶(P450c17α酶)丝氨酸磷酸化异常,引起卵巢及肾上腺合成的雄激素增多,导致高雄激素血症。研究证实导致PCOS胰岛素抵抗可能还与循环中某些炎症因子和脂肪细胞因子的异常有关:(1)炎症因子:对PCOS病人的研究发现,一些炎性因子如血清C-反应蛋白(CRP)、IL-6、IL-18及TNF-α血清浓度升高,近年研究已经明确这些炎症因子可通过干扰胰岛素信号通路重要分子的表达及活性而引起IR。1)IL-6:是一个多效能的细胞炎症因子,有研究表明,IL-6与胰岛素抵抗有关,其与胰岛素水平保持着动态平衡,低水平的IL-6可以促进胰岛素分泌,而高水平则抑制其分泌。升高的IL-6通过以下机制引起IR:①诱导SOCS蛋白的表达,从而通过抑制IRS21酪氨酸磷酸化,使胰岛素信号传导受阻;②能降低GLUT-4mRNA的表达,削弱胰岛素刺激的葡萄糖转运功能,升高血清游离脂肪酸,促进脂质氧化,抑制脂肪组织脂蛋白脂酶活性等途径对抗胰岛素作用。2)肿瘤坏死因子-α(TNF-α):是一种非糖基化蛋白,由多种炎症细胞合成或分泌,脂肪细胞也是其重要来源。PCOS病人TNF-α水平显著高于正常人群,且肥胖者升高更明显。升高的TNF-α通过以下机制引起IR:①减少IRS-1的酪氨酸磷酸化,抑制胰岛素信号传导;②促进脂肪分解,增加游离脂肪酸,间接影响胰岛素敏感性;③下调脂肪细胞中多种重要的信号分子或蛋白表达,从而导致IR。3)C-反应蛋白(CRP):是炎症急性期反应蛋白,主要受循环IL-6和TNF-α的调节。当CRP水平升高激活慢性免疫系统,则发生炎症反应。研究表明,PCOS病人血CRP水平明显升高。CRP导致IR的作用机制:主要是促进TNF-α释放,干扰胰岛素的早期信号转导;抑制脂肪合成,增加脂肪分解和纤溶酶原激活抑制因子(PAI-1)的分泌;抑制GLUT4、PPARγ的表达,加重IR。(2)脂肪细胞因子:近十多年以来,脂肪组织为内分泌器官已成为学术界的共识,许多脂肪细胞因子如瘦素(leptin)、脂联素(adiponectin)、抵抗素相继被发现与IR有关。近年研究发现这些脂肪因子在PCOS病人IR的发生中也起一定作用。1)瘦素:众多研究证实,瘦素与胰岛素之间具有双向调节作用,胰岛素可刺激体外培养的脂肪组织瘦素mRNA表达,瘦素可通过干扰胰岛素信号通路,而加重IR。Remsberg等也发现,PCOS病人IR、雄激素水平及体质指数(BMI)与瘦素水平有关系。肥胖病人瘦素分泌增加,因此肥胖病人瘦素是加重IR的重要因素。2)脂联素:通过干预机体糖脂代谢途径,参与了IR相关疾病的发生发展过程,低脂联素血症的程度与IR及高胰岛素血症具有显著相关性。Carmina等比较了年龄、BMI相匹配的52名PCOS妇女与45名正常排卵的妇女性激素水平、IR参数和脂联素水平,发现病人脂联素水平明显降低,这可能导致病人脂肪分布与功能异常。Ardawi等认为,无论是肥胖的还是消瘦的PCOS病人只要有不同程度的IR,她们就有低脂联素血症,这表明PCOS的IR或其他代谢紊乱影响脂联素浓度的调控。(3)雄激素:高胰岛素可引起高雄激素血症如上述,但是研究也证实,高雄激素血症亦可引起IR。呈中枢性肥胖的女性体内的游离雄激素水平普遍高于正常对照组,且胰岛素抵抗的程度也较正常对照组明显加重。Cohen等发现,滥用雄激素的女运动员普遍存在胰岛素抵抗。再生障碍性贫血的病人给予雄激素治疗后,可出现葡萄糖耐量异常以及胰岛素水平升高。Givens等发现,分泌雄激素的肿瘤病人存在的黑棘皮病(胰岛素抵抗的重要的临床体征)在手术切除肿瘤后得以明显改善。近年有一项研究发现,高雄激素血症的病人给予螺内酯、氟他胺及GnRH-a等降雄激素药物治疗后,其胰岛素抵抗均得到明显改善。高雄激素血症引起IR可能机制为:①雄激素可能直接或间接影响体内葡萄糖的代谢而导致高胰岛素血症;②雄激素也可直接抑制外周及肝脏内胰岛素的作用而导致高胰岛素血症。Ciaraldi等发现,PCOS病人脂肪细胞上的胰岛素受体及其激酶活性并未见异常,而葡萄糖摄取能力明显下降;故推测PCOS病人的胰岛素抵抗是由胰岛素受体后环节缺陷引起的,并可能与雄激素水平升高有关;笔者医院的研究表明,雄激素可通过抑制胰岛素受体后信号通路传导分子的表达而导致胰岛素抵抗。另外,雄激素还可以增加游离脂肪酸的生成,从而抑制肝脏胰岛素的清除而引起高胰岛素血症,进而导致胰岛素抵抗。高雄激素血症与高胰岛素的相互影响见图21-6-1所示。4.排卵障碍 PCOS排卵障碍的机制包括卵巢的内分泌调控激素及卵巢局部因子的异常。(1)FSH不足,LH过高:PCOS病人卵泡数量的增多,产生过多的抑制素B(INH B)及其分泌的雌激素可抑制垂体FSH的释放。FSH是卵泡进入周期募集和进一步发育的关键激素;卵泡不能有突破性生长的主要原因可能是PCOS病人循环中FSH偏低。另外,PCOS病人循环中的LH持续升高,常促使已发育为窦腔期的卵泡闭锁或过早黄素化。
 图21-6-1 高雄激素血症与高胰岛素的相互影响(2)卵巢局部因子比例失衡:研究发现,PCOS对FSH的反应性较正常对照组降低与其卵巢局部产生一些抑制FSH作用的因子有关。目前研究比较多的是AMH,AMH是由生长卵泡的颗粒细胞分泌,可抑制FSH作用,但机制尚不清楚。正常情况下,FSH与AMH之间存在着平衡。当循环中FSH水平上升时,FSH/AMH比例增加,可增强芳香化酶的活性,促进卵泡正常发育及周期募集,最终发育成熟;成熟卵泡分泌的INH B反过来又抑制垂体FSH的分泌,这样周而复始。在PCOS病人体内,AMH与FSH之间失去了这种平衡,使FSH/AMH比例降低,从而抑制了芳香化酶的作用,最终抑制卵泡的发育,导致排卵障碍。研究已证实,PCOS病人血清中米勒管抑制因子(AMH)水平比正常人高出2~3倍(图21-6-2)。另外,也有研究发现高胰岛素血症能影响颗粒细胞的分化。体外试验证实胰岛素能增加颗粒细胞对LH的反应能力,提示PCOS无排卵妇女的胰岛素升高可能也是卵泡期促进卵泡闭锁的主要原因之一。5.并发症(1)代谢综合征(metabolic syndrome,MS):包含肥胖、糖尿病(diabetes)、高血压、血脂异常四大组分。
图21-6-1 高雄激素血症与高胰岛素的相互影响(2)卵巢局部因子比例失衡:研究发现,PCOS对FSH的反应性较正常对照组降低与其卵巢局部产生一些抑制FSH作用的因子有关。目前研究比较多的是AMH,AMH是由生长卵泡的颗粒细胞分泌,可抑制FSH作用,但机制尚不清楚。正常情况下,FSH与AMH之间存在着平衡。当循环中FSH水平上升时,FSH/AMH比例增加,可增强芳香化酶的活性,促进卵泡正常发育及周期募集,最终发育成熟;成熟卵泡分泌的INH B反过来又抑制垂体FSH的分泌,这样周而复始。在PCOS病人体内,AMH与FSH之间失去了这种平衡,使FSH/AMH比例降低,从而抑制了芳香化酶的作用,最终抑制卵泡的发育,导致排卵障碍。研究已证实,PCOS病人血清中米勒管抑制因子(AMH)水平比正常人高出2~3倍(图21-6-2)。另外,也有研究发现高胰岛素血症能影响颗粒细胞的分化。体外试验证实胰岛素能增加颗粒细胞对LH的反应能力,提示PCOS无排卵妇女的胰岛素升高可能也是卵泡期促进卵泡闭锁的主要原因之一。5.并发症(1)代谢综合征(metabolic syndrome,MS):包含肥胖、糖尿病(diabetes)、高血压、血脂异常四大组分。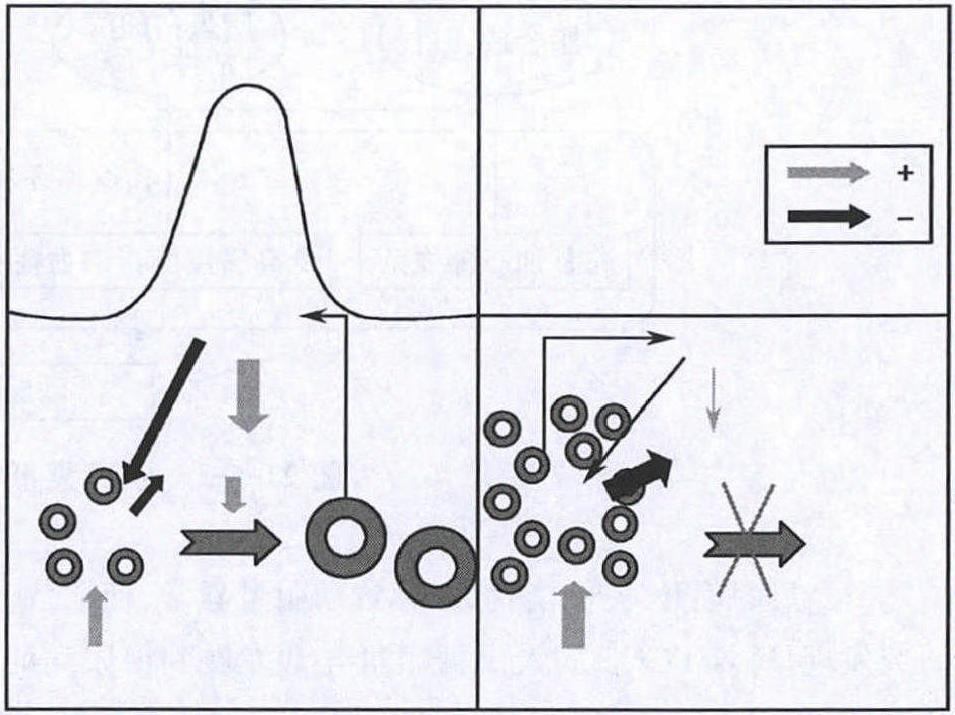 图21-6-2 左图示正常卵巢,右图示PCOS卵巢PCOS是发生MS的高风险人群,这主要与胰岛素抵抗有关;胰岛素抵抗是代谢综合征四大组分的中心环节。2005年的一项回顾性研究发现,161名3年以上病史的PCOS病人的代谢综合征的发生率高达43%,而在年龄相匹配的普通人群中代谢综合征的发生率仅为24%。该项研究发现PCOS病人的代谢综合征的各个组分的发生率如下:HDL-C降低的发生率为68%,BMI增高的发生率67%,高血压45%、高TG35%、高血糖4%。1)肥胖:PCOS病人中肥胖的发生率约10%~50%,主要与基因易感性密切相关。肥胖可反过来加重PCOS的病情发展。与非肥胖的PCOS病人相比较,肥胖的PCOS病人循环中的SHBG、HDL下降,而循环中的LDL水平是升高的。50%~60%的PCOS病人表现为腹型肥胖,后者可加重高雄激素血症及高胰岛素血症。高胰岛素血症可通过增加脂肪细胞对葡萄糖的摄取、甘油三酯的合成,可导致肥胖的产生。2)脂代谢异常:PCOS病人与正常人相比发生脂代谢异常的相对危险度为1.8。由于高胰岛素血症、高雄激素血症均可以影响脂蛋白的脂代谢,故PCOS病人出现脂代谢异常的比例可高达70%。高胰岛素血症可促进极低密度脂蛋白(VLDL)和中间密度脂蛋白(IDL)等富含TG脂蛋白(TRL)的生成,并抑制VLDL的清除,抑制高密度脂蛋白(HDL)的合成,促进HDL的分解,并增加肝脂肪酶(HL)的活性,促进脂解,引起FFA增多,后者刺激肝脏合成及分泌大量的TG。睾酮也可降低HDL-c的合成。故PCOS IR病人可出现高VLDL、高LDL血症、低HDL血症及高TG血症等脂代谢紊乱。3)非酒精性脂肪肝(NAFLD): NAFLD是比较复杂的、多因素疾病。胰岛素抵抗在NAFLD的发生发展中起着重要的作用。4)高血压:PCOS病人出现高血压是与胰岛素抵抗密切相关。其可能机制:①高胰岛素可激活RAAS系统,后者可增加肾脏对钠的重吸收,使血压升高;②高胰岛素血症使Na+/K+-ATP酶的活性降低,造成细胞内高钠导致细胞水肿,同时Ca2+-ATP酶活性降低,细胞内钙浓度增加,提高小动脉血管平滑肌对血管加压物质的反应;③通过刺激交感神经系统引起血管收缩;④通过刺激IGF-1的生成及活性增加,引起血管平滑肌的肥大,使动脉内膜增厚,最终导致器质性动脉硬化性高血压。故PCOS病人发生高血压及冠心病的风险较正常女性明显增高(图21-6-3)。
图21-6-2 左图示正常卵巢,右图示PCOS卵巢PCOS是发生MS的高风险人群,这主要与胰岛素抵抗有关;胰岛素抵抗是代谢综合征四大组分的中心环节。2005年的一项回顾性研究发现,161名3年以上病史的PCOS病人的代谢综合征的发生率高达43%,而在年龄相匹配的普通人群中代谢综合征的发生率仅为24%。该项研究发现PCOS病人的代谢综合征的各个组分的发生率如下:HDL-C降低的发生率为68%,BMI增高的发生率67%,高血压45%、高TG35%、高血糖4%。1)肥胖:PCOS病人中肥胖的发生率约10%~50%,主要与基因易感性密切相关。肥胖可反过来加重PCOS的病情发展。与非肥胖的PCOS病人相比较,肥胖的PCOS病人循环中的SHBG、HDL下降,而循环中的LDL水平是升高的。50%~60%的PCOS病人表现为腹型肥胖,后者可加重高雄激素血症及高胰岛素血症。高胰岛素血症可通过增加脂肪细胞对葡萄糖的摄取、甘油三酯的合成,可导致肥胖的产生。2)脂代谢异常:PCOS病人与正常人相比发生脂代谢异常的相对危险度为1.8。由于高胰岛素血症、高雄激素血症均可以影响脂蛋白的脂代谢,故PCOS病人出现脂代谢异常的比例可高达70%。高胰岛素血症可促进极低密度脂蛋白(VLDL)和中间密度脂蛋白(IDL)等富含TG脂蛋白(TRL)的生成,并抑制VLDL的清除,抑制高密度脂蛋白(HDL)的合成,促进HDL的分解,并增加肝脂肪酶(HL)的活性,促进脂解,引起FFA增多,后者刺激肝脏合成及分泌大量的TG。睾酮也可降低HDL-c的合成。故PCOS IR病人可出现高VLDL、高LDL血症、低HDL血症及高TG血症等脂代谢紊乱。3)非酒精性脂肪肝(NAFLD): NAFLD是比较复杂的、多因素疾病。胰岛素抵抗在NAFLD的发生发展中起着重要的作用。4)高血压:PCOS病人出现高血压是与胰岛素抵抗密切相关。其可能机制:①高胰岛素可激活RAAS系统,后者可增加肾脏对钠的重吸收,使血压升高;②高胰岛素血症使Na+/K+-ATP酶的活性降低,造成细胞内高钠导致细胞水肿,同时Ca2+-ATP酶活性降低,细胞内钙浓度增加,提高小动脉血管平滑肌对血管加压物质的反应;③通过刺激交感神经系统引起血管收缩;④通过刺激IGF-1的生成及活性增加,引起血管平滑肌的肥大,使动脉内膜增厚,最终导致器质性动脉硬化性高血压。故PCOS病人发生高血压及冠心病的风险较正常女性明显增高(图21-6-3)。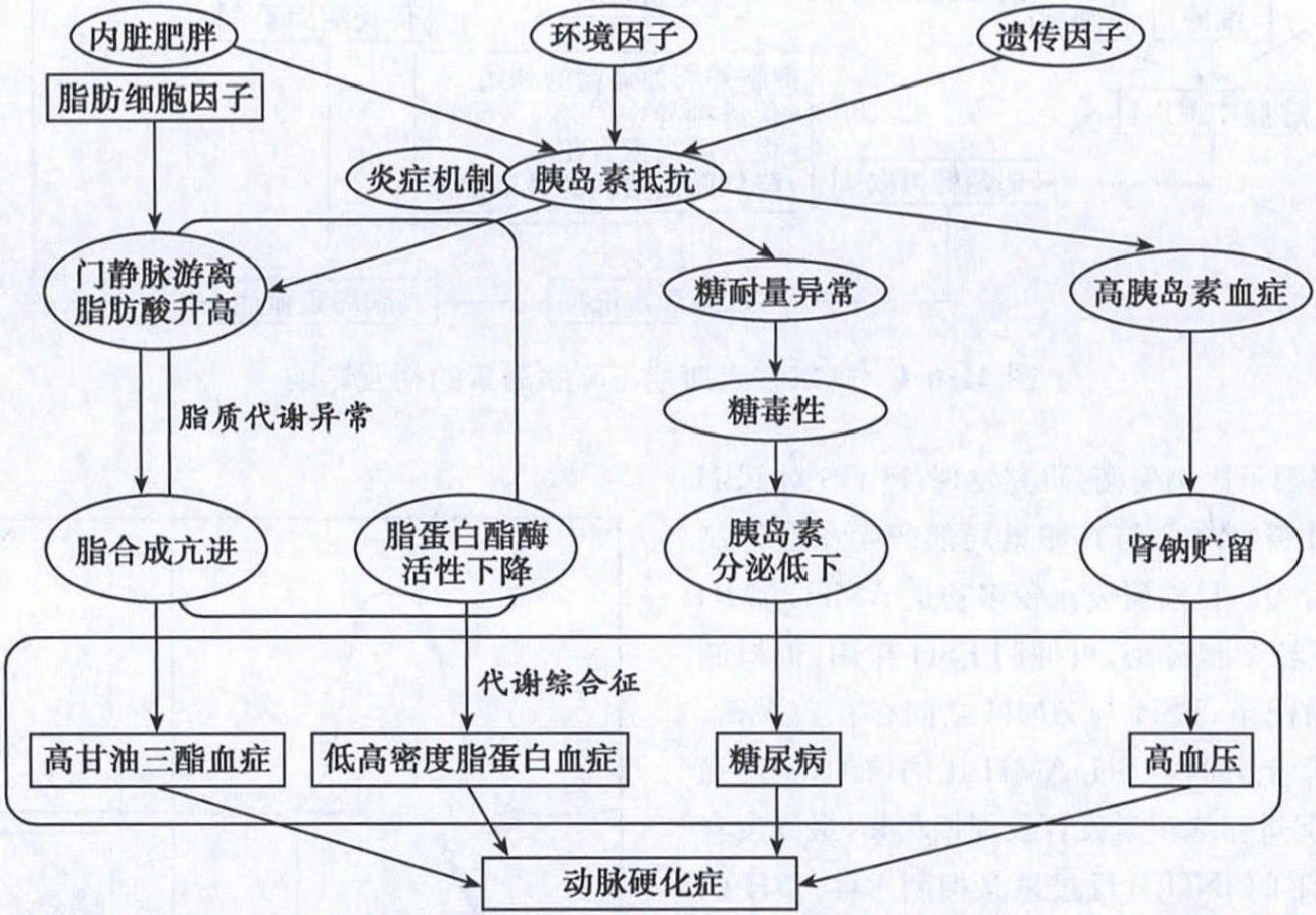 图21-6-3 胰岛素抵抗引起代谢综合征的机制5)糖尿病:IR失代偿时,可导致糖耐量异常、糖尿病。研究发现,每年PCOS病人由糖耐量异常发展到糖尿病的比率(2%→10.75%)较正常女性(1%→7%)要高。40岁以下的PCOS病人中35%为糖耐量异常,10%为糖尿病。PCOS病人表现为全身性IR。高胰岛素血症可使肝糖原的产生及分泌增多,引起空腹血糖升高,导致肝抵抗;骨骼肌对胰岛素的敏感性下降,葡萄糖摄取减少,肌糖原生成、贮存减少,导致肌抵抗;脂解作用增强,游离脂肪酸(FFA)生成增多,使血浆中FFA浓度升高,增高的FFA可同时促进肝糖原异生,并抑制肌肉细胞胰岛素介导的葡萄糖转运活动;另外,在IR状态下,胰岛B细胞功能缺陷失代偿时,血糖升高。升高的血糖不仅抑制胰岛素分泌,同时也抑制肌肉细胞胰岛素刺激的葡萄糖转运和肌糖原的合成,进一步加重IR,形成恶性循环。6)阻塞性睡眠呼吸暂停(OSA):PCOS病人发生阻塞性睡眠呼吸暂停的几率是正常女性的5~30倍,但目前机制不明。与年龄、体质指数、雄激素等因素相比,IR是OSA的更强有力的预测因子。7)血浆黏度与促血栓状态:血浆黏度是血液流变学中很重要的一个观察指标,主要受循环中一些大分子影响,如纤维蛋白原、免疫球蛋白以及脂蛋白;血浆黏度升高说明机体组织内的血流阻力是增加的。血浆黏度与空腹胰岛素及胆固醇的水平密切相关。高胰岛素血症通过抑制纤维蛋白溶解、增加纤溶酶原激活物抑制剂-1(PAI-1),进而促进血栓状态的形成。8)内皮功能与代谢性炎症:PCOS病人出现内皮功能异常的可能机制:①NO的合成及释放减少;②引起血管收缩的物质增加;③高胰岛素可直接引起血管内皮及血管平滑肌肥大。PCOS病人循环中的炎症因子水平较正常女性明显升高,为持续低度炎症,即代谢性炎症状态。目前的研究认为,PCOS的代谢性炎症可进一步加重PCOS的代谢紊乱。(2)PCOS子宫内膜样腺癌:PCOS病人由于长期无排卵,子宫内膜在无孕激素保护的雌激素长期作用下,容易发生增生病变,甚至发生子宫内膜样腺癌。研究发现,PCOS病人发生子宫内膜样腺癌的风险是正常人群的4倍;PCOS病人中子宫内膜样腺癌发生率为19%~25%。近年发现PCOS病人的子宫内膜增生病变除了与雌激素长期作用有关外,还与胰岛素作用下的局部IGF-Ⅰ及其活性的增高有关。有些子宫内膜增生病变的PCOS病人对孕激素治疗不敏感,孕激素治疗不敏感的可能机制:局部生长因子尤其是IGF-Ⅰ,具很强的促有丝分裂作用,并可促进雌激素受体表达,使雌激素作用增强,导致子宫内膜细胞不断增生;另外局部生长因子抑制内膜细胞的凋亡,而且升高的胰岛素样生长因子能增加内膜细胞VEGF合成,促进LHRH和LH释放,降低体内脂联素水平等,因此能抑制孕激素对子宫内膜的保护作用。
图21-6-3 胰岛素抵抗引起代谢综合征的机制5)糖尿病:IR失代偿时,可导致糖耐量异常、糖尿病。研究发现,每年PCOS病人由糖耐量异常发展到糖尿病的比率(2%→10.75%)较正常女性(1%→7%)要高。40岁以下的PCOS病人中35%为糖耐量异常,10%为糖尿病。PCOS病人表现为全身性IR。高胰岛素血症可使肝糖原的产生及分泌增多,引起空腹血糖升高,导致肝抵抗;骨骼肌对胰岛素的敏感性下降,葡萄糖摄取减少,肌糖原生成、贮存减少,导致肌抵抗;脂解作用增强,游离脂肪酸(FFA)生成增多,使血浆中FFA浓度升高,增高的FFA可同时促进肝糖原异生,并抑制肌肉细胞胰岛素介导的葡萄糖转运活动;另外,在IR状态下,胰岛B细胞功能缺陷失代偿时,血糖升高。升高的血糖不仅抑制胰岛素分泌,同时也抑制肌肉细胞胰岛素刺激的葡萄糖转运和肌糖原的合成,进一步加重IR,形成恶性循环。6)阻塞性睡眠呼吸暂停(OSA):PCOS病人发生阻塞性睡眠呼吸暂停的几率是正常女性的5~30倍,但目前机制不明。与年龄、体质指数、雄激素等因素相比,IR是OSA的更强有力的预测因子。7)血浆黏度与促血栓状态:血浆黏度是血液流变学中很重要的一个观察指标,主要受循环中一些大分子影响,如纤维蛋白原、免疫球蛋白以及脂蛋白;血浆黏度升高说明机体组织内的血流阻力是增加的。血浆黏度与空腹胰岛素及胆固醇的水平密切相关。高胰岛素血症通过抑制纤维蛋白溶解、增加纤溶酶原激活物抑制剂-1(PAI-1),进而促进血栓状态的形成。8)内皮功能与代谢性炎症:PCOS病人出现内皮功能异常的可能机制:①NO的合成及释放减少;②引起血管收缩的物质增加;③高胰岛素可直接引起血管内皮及血管平滑肌肥大。PCOS病人循环中的炎症因子水平较正常女性明显升高,为持续低度炎症,即代谢性炎症状态。目前的研究认为,PCOS的代谢性炎症可进一步加重PCOS的代谢紊乱。(2)PCOS子宫内膜样腺癌:PCOS病人由于长期无排卵,子宫内膜在无孕激素保护的雌激素长期作用下,容易发生增生病变,甚至发生子宫内膜样腺癌。研究发现,PCOS病人发生子宫内膜样腺癌的风险是正常人群的4倍;PCOS病人中子宫内膜样腺癌发生率为19%~25%。近年发现PCOS病人的子宫内膜增生病变除了与雌激素长期作用有关外,还与胰岛素作用下的局部IGF-Ⅰ及其活性的增高有关。有些子宫内膜增生病变的PCOS病人对孕激素治疗不敏感,孕激素治疗不敏感的可能机制:局部生长因子尤其是IGF-Ⅰ,具很强的促有丝分裂作用,并可促进雌激素受体表达,使雌激素作用增强,导致子宫内膜细胞不断增生;另外局部生长因子抑制内膜细胞的凋亡,而且升高的胰岛素样生长因子能增加内膜细胞VEGF合成,促进LHRH和LH释放,降低体内脂联素水平等,因此能抑制孕激素对子宫内膜的保护作用。 -
+临床表现
临床表现:1.月经失调 见于75%~85%的PCOS病人。可表现为:月经稀发(每年月经次数≤6次)、闭经或不规则子宫出血。2.不育症 一对夫妇结婚后同居、有正常性生活(未避孕)1年尚未怀孕者称为不育。须检查排除男方和输卵管异常,并确认无排卵或稀发排卵。3.雄激素过多症(1)痤疮:PCOS病人中约15%~25%有痤疮,病变多见于面部,前额、双颊等,胸背、肩部也可出现。痤疮的分级为:轻-中度者以粉刺、红斑丘疹、丘脓疱疹为主;重度者以脓疱结节、囊肿、结疤炎症状态为主(表21-6-1)。表21-6-1 痤疮评分标准
评分 类型 临床表现 0 无 无 1 轻微 痤疮≥2mm,面部或躯干<10个 2 轻 痤疮10~20个 3 中 痤疮>20个或脓疱<20个 4 重 脓疱≥20个 5 囊性 炎性病损≥5mm (2)多毛症(hirsutism):性毛过多指雄激素依赖性体毛过度生长,PCOS病人中患多毛症者约65%~75%(图21-6-4)。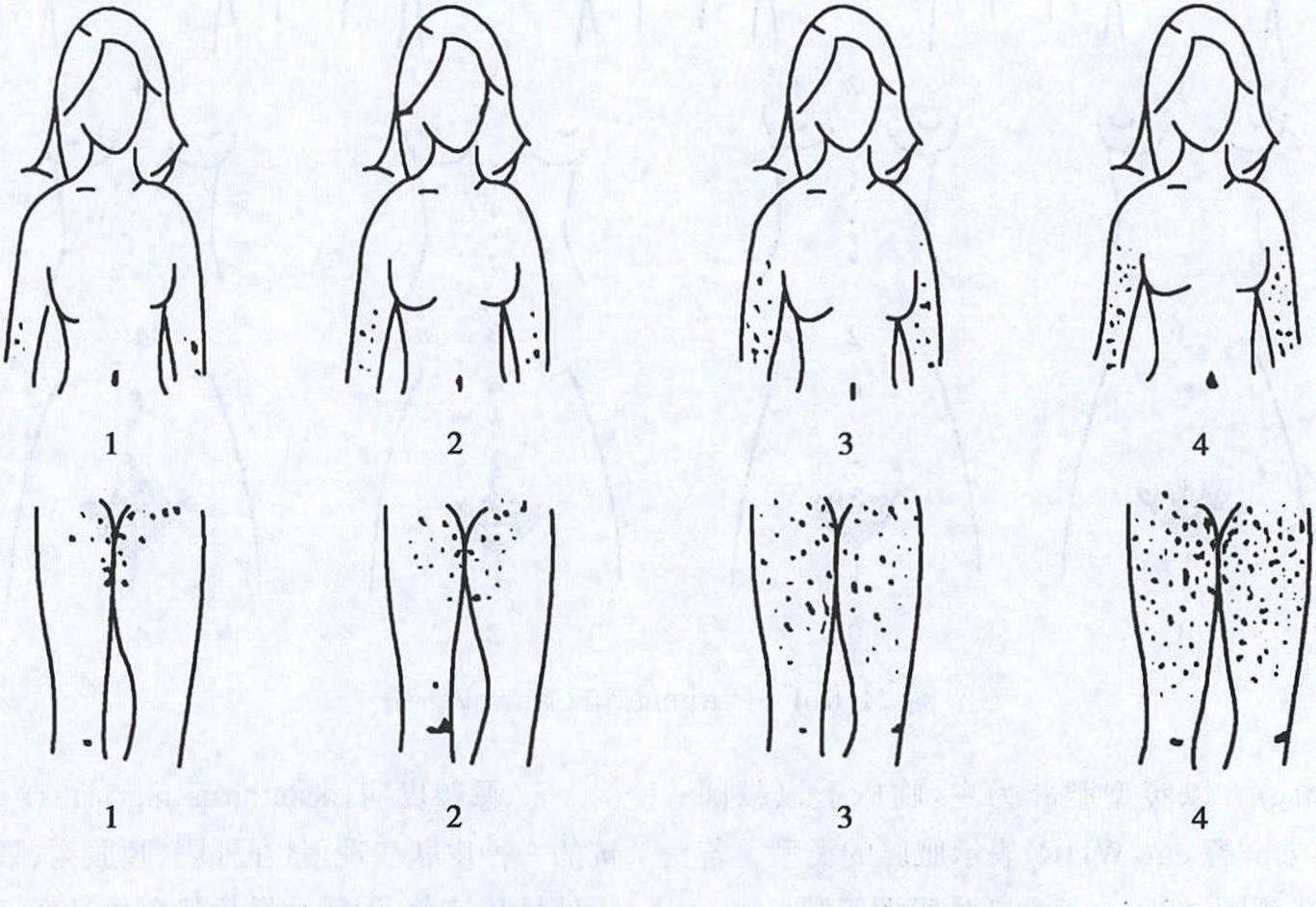
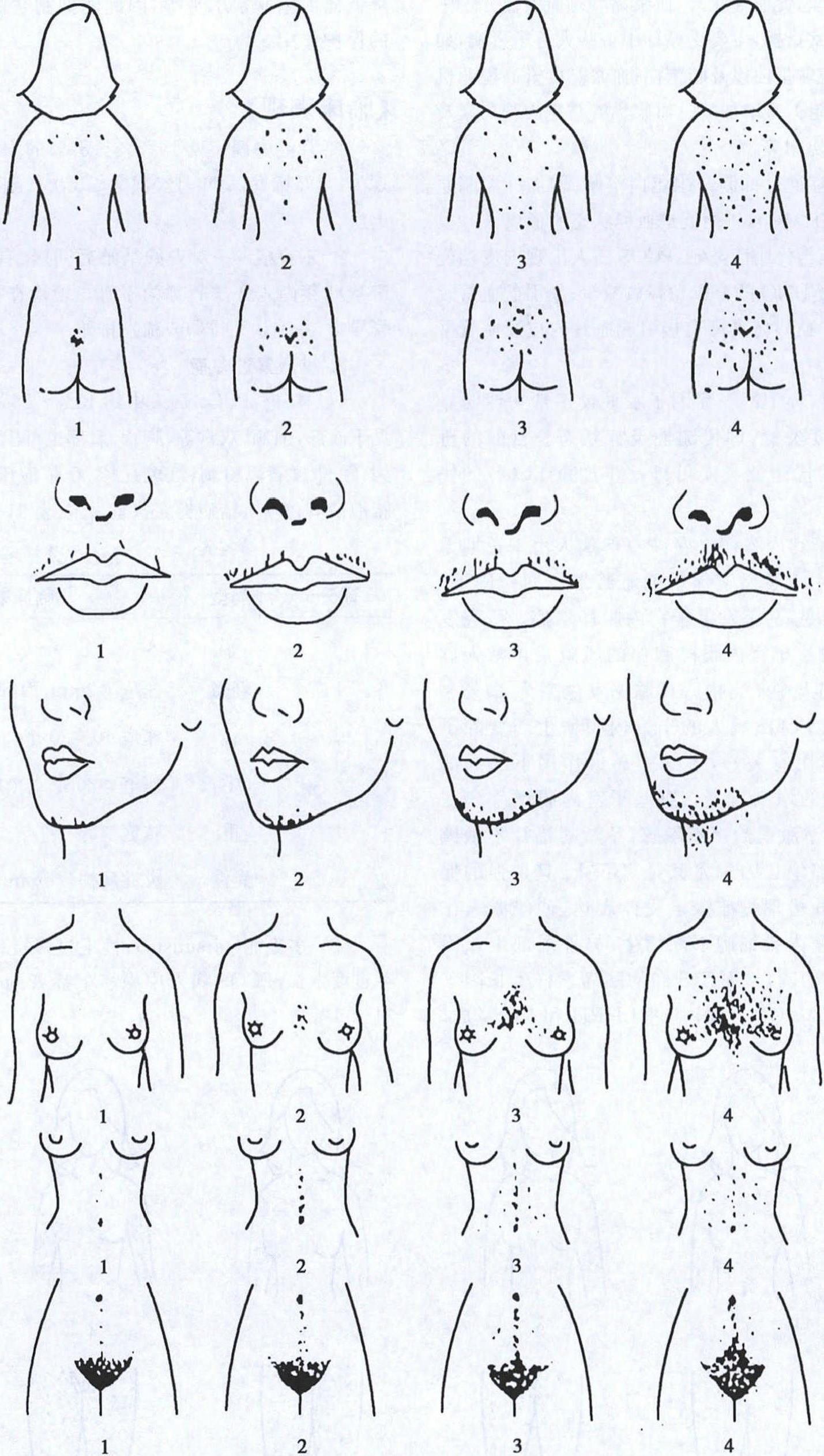 图21-6-4 Ferriman和Gallway评分4.肥胖(obesity) 以腹型肥胖为主,临床上以腰围(WR)或腰臀比(腰cm/臀cm,WHR)表示肥胖的类型。若女性WHR≥0.8,或腰围≥85cm可诊断为腹型肥胖。5.黑棘皮病(acanthosis nigricans) 是严重胰岛素抵抗的一种皮肤表现,常在外阴、腹股沟、腋下、颈后等皮肤皱折处呈灰棕色、天鹅绒样片状角化过度,有时呈疣状。分为轻、中、重度。0:无黑棘皮病;1+:颈部&腋窝有细小的疣状斑块,伴/不伴有受累皮肤色素沉着;2+:颈部&腋窝有粗糙的疣状斑块,伴/不伴有受累皮肤色素沉着;3+:颈部&腋窝及躯干有粗糙的疣状斑块,伴/不伴有受累皮肤色素沉着。
图21-6-4 Ferriman和Gallway评分4.肥胖(obesity) 以腹型肥胖为主,临床上以腰围(WR)或腰臀比(腰cm/臀cm,WHR)表示肥胖的类型。若女性WHR≥0.8,或腰围≥85cm可诊断为腹型肥胖。5.黑棘皮病(acanthosis nigricans) 是严重胰岛素抵抗的一种皮肤表现,常在外阴、腹股沟、腋下、颈后等皮肤皱折处呈灰棕色、天鹅绒样片状角化过度,有时呈疣状。分为轻、中、重度。0:无黑棘皮病;1+:颈部&腋窝有细小的疣状斑块,伴/不伴有受累皮肤色素沉着;2+:颈部&腋窝有粗糙的疣状斑块,伴/不伴有受累皮肤色素沉着;3+:颈部&腋窝及躯干有粗糙的疣状斑块,伴/不伴有受累皮肤色素沉着。- +并发症
- +实验室检查
实验室检查:1.血中LH/FSH大于正常比。2.血中睾酮和雄烯二酮水平均高于正常值。3.血雌酮(E1)、雌二醇(E2)测定,E1/E2比例大于月经周期中的比例。4.尿17-酮类固醇含量正常,提示雄激素来源于卵巢;尿17-酮类固醇含量升高,则提示肾上腺皮质功能亢进。5.高胰岛素血症。- +其他辅助检查
其他辅助检查:除激素测定外,CT检查和超声波等检查均可协助诊断。采用高分辨率阴道超声技术观察多囊卵巢的形态,是简便易行、无创伤的诊断方法。- +诊断
诊断:1.不论症状还是生化异常PCOS病人均呈现种族和个体差异。多年来对PCOS的诊断一直存在争议,近二十年国际上陆续推出四个标准:(1)1990年NIH标准:1990年美国国立卫生研究院(National institute health,NIH)对PCOS诊断标准包括以下两项(按重要性排序):①雄激素过多症及(或)高雄激素血症;②稀发排卵。但需排除以下高雄激素疾病,如先天性21-羟化酶缺乏、库欣综合征、高泌乳素及分泌雄激素的肿瘤等;使标准化诊断迈出了重要的一步。该标准包括了三种基本表现型:①多毛、高雄血症及稀发排卵;②多毛及稀发排卵;③高雄血症及稀发排卵。(2)2003年鹿特丹标准:随着诊断技术的进展、阴道超声的广泛应用,许多学者报道超过50%的PCOS病人具有卵巢多囊改变特征,2003年由美国生殖医学会(American Society for Reproductive Medicine,ASRM)及欧洲人类生殖与胚胎协会(European society of human reproduction and embryology,ESHRE)在鹿特丹举办专家会对PCOS诊断达成新的共识,加入了关于卵巢多囊改变的标准,并提出PCOS需具备以下三项中两项:①稀发排卵及(或)无排卵;②雄激素过多的临床体征及(或)生化指标;③卵巢多囊改变。同样需排除其他雄激素过多的疾病或相关疾病;此标准较NIH标准增加了两个新的表型:①多囊卵巢、多毛和(或)高雄血症,但排卵功能正常;②多囊卵巢、排卵不规则,但没有雄激素增多症。此标准的提出引起医学界广泛争论,支持该标准的一方认为该标准提出新表型,对病因和异质性的认识有帮助;反对的一方则认为,该标准提出的新表型尚缺乏资料,且两种新表型的临床重要性不确定。(3)2006年AES标准:2006年美国雄激素过多协会(Androgen Excess Society,AES)对PCOS又提出如下标准,必须具备以下两项:①多毛及(或)高雄激素血症;②稀发排卵及(或)多囊卵巢。此标准同样需排除其他雄激素过多或相关疾病,与鹿特丹标准不同的是此标准强调必须具备第一条。(4)2013美国内分泌学会标准:为了进一步扩大共识、规范操作,美国内分泌学会(The Endocrine Society)年颁布了PCOS的诊断指南,本指南沿用2003年鹿特丹诊断标准,即符合以下三条中的两条,并排除其他疾病导致的类似临床表现,即可诊断PCOS:①雄激素过多的临床和(或)生化表现,如多毛,痤疮,雄激素性脱发,血清总睾酮或游离睾酮升高;②稀发排卵或无排卵;③卵巢多囊样改变,即单侧卵巢体积增大超过10ml(排除囊肿及优势卵泡)或单侧卵巢内有超过12个的直径2~9mm卵泡。指南指出,如果病人存在高雄激素的临床表现,且合并女性男性化,那么血清雄激素测定可以不作为诊断必需。同样,若病人同时存在高雄激素体征和排卵障碍,那么卵巢超声表现可以不作为诊断必备条件。另外,该指南推荐所有病人筛查TSH、催乳素及17-羟孕酮,来除外一些常见的可致相似临床表现的疾病。该指南特别提出对于青春期、育龄期、围绝经期及绝经后女性诊断侧重点不同。对于青春期女性,诊断应基于临床和(或)生化高雄激素表现及持续性稀发月经,并除外其他原因导致的高雄激素表现。2011年中国的妇科内分泌专家提出了中国PCOS的诊断标准:①疑似PCOS:月经稀发或闭经或不规则子宫出血是诊断必须条件。另外再符合下列两项中的一项即可诊断为疑似PCOS: a.高雄激素的临床表现或高雄激素血症;b.超声表现为PCO。②确定诊断:具备上述疑似PCOS诊断条件后还必须逐一排除其他可能引起高雄激素的疾病和引起排卵异常的疾病才能确定诊断。③排除疾病:下丘脑性闭经、甲状腺功能异常、高催乳素血症、迟发型肾上腺皮质增生、卵巢或肾上腺分泌雄激素肿瘤等。2. 实验室测定(1)雄激素的测定:正常妇女循环中雄激素有睾酮、雄烯二酮、去氢表雄酮及其硫酸盐4种。临床上常规检查项目为血清总睾酮及硫酸脱氢表雄酮。目前尚缺乏我国女性高雄激素的实验室诊断标准。(2)促性腺激素的测定(LH、FSH):研究显示PCOS病人LH/FSH比值>2~3,但这一特点仅见于无肥胖的PCOS病人。由于肥胖可抑制GnRH/LH脉冲分泌振幅,使肥胖PCOS病人LH水平及LH/FSH比值不升高,故LH/FSH比值不作为PCOS的诊断依据。3.盆腔超声检查 多囊卵巢(PCO)是超声检查对卵巢形态的一种描述。根据鹿特丹专家共识PCO超声相的定义为:一个或多个切面可见一侧或双侧卵巢内直径2~9mm的卵泡≥12个,和(或)卵巢体积≥10ml(卵巢体积按0.5×长径×横径×前后径计算)。注意:超声检查前应停用口服避孕药至少1个月,在规则月经病人中应选择在周期第3~5天检查。稀发排卵病人若有卵泡直径>10mm或有黄体出现,应在下个周期进行复查。除未婚病人外,应选择经阴道超声检查;青春期女孩应采用经直肠超声检查。4.基础体温(BBT)测定 PCOS病人应于每天早晨醒后立即测试舌下体温(舌下放置5分钟),至少一个月经周期,并记录在坐标纸上。测试前禁止起床、说话、大小便、进食、吸烟等活动。根据体温曲线的形状可以了解有无排卵,并估计排卵日期,早期诊断妊娠。- +鉴别诊断
鉴别诊断:PCOS的鉴别诊断 临床上引起雄激素过多的疾病很多,在诊断PCOS的高雄激素血症时,需要排除这些疾病。(1)先天性肾上腺皮质增生症:引起雄激素过多的先天性肾上腺皮质增生症(CAH)有两种:21-羟化酶缺陷和11β-羟化酶缺陷。21-羟化酶缺陷是最常见的先天性肾上腺皮质增生症,占CAH总数的90%~95%,11β-羟化酶缺陷较罕见。根据临床表现21-羟化酶缺陷可分为3种:失盐性肾上腺皮质增生症、单纯男性化型和非典型肾上腺皮质增生症,后者又被称为迟发性肾上腺皮质增生症;其中容易与PCOS相混淆的是非典型肾上腺皮质增生症。临床上诊断非典型肾上腺皮质增生症依靠内分泌测定,其中最重要的是血17-羟孕酮水平的测定。非典型肾上腺皮质增生症者的血17-羟孕酮和血孕酮水平升高、FSH水平正常、LH水平升高、睾酮水平轻度升高、DHEAS水平升高。如果血17-羟孕酮水平<2ng/ml,则可排除非典型肾上腺皮质增生症;如果>10ng/ml,则可诊断为非典型肾上腺皮质增生症;如果血17-羟孕酮水平为2~10ng/ml,则需要做ACTH试验。静脉注射ACTH 60分钟后,测定血17-羟孕酮水平,如果>10ng/ml,则可诊断为非典型肾上腺皮质增生症,否则排除该诊断。(2)分泌雄激素的肿瘤:有卵巢泡膜细胞瘤、卵巢支持-间质细胞肿瘤、卵巢类固醇细胞肿瘤和肾上腺分泌雄激素的肿瘤。如果存在分泌雄激素的肿瘤,病人体内的雄激素水平会异常升高,通常血睾酮水平超过3ng/ml。影像学检查可协助诊断,通常会发现肾上腺或卵巢的包块,确诊依赖手术病理检查。(3)Cushing综合征:Cushing综合征病人也有高雄激素血症,但病人最突出的临床表现是由皮质醇过多引起的,如满月脸、向心型肥胖等。血皮质醇和ACTH水平升高可资鉴别。- +治疗
治疗:1.治疗原则 按有无生育要求及有无并发症分为基础治疗、并发症治疗及促孕治疗三方面。基础治疗是指针对PCOS病人月经失调、雄激素过多症、胰岛素抵抗及肥胖的治疗,包括控制月经周期治疗、降雄激素治疗、降胰岛素治疗及控制体重治疗四方面。治疗目的:促进排卵功能恢复,改善雄激素过多体征,阻止子宫内膜增生病变和癌变,以及阻止代谢综合征的发生。以上治疗可根据病人的情况,采用单一或两种及以上治疗方法联合应用。并发症的治疗指对已发生子宫内膜增生病变或代谢综合征,包括糖耐量受损、2型糖尿病、高血压等的治疗。促孕治疗包括药物促排卵、卵巢手术促排卵及生殖辅助技术,一般用于基础治疗后仍未受孕者;但任何促孕治疗应在纠正孕前健康问题后进行,以降低孕时并发症。2.治疗方法(1)基础治疗1)降体重疗法:肥胖型PCOS病人调整生活方式(饮食控制和适当运动量)是一线治疗。早在1935年,Stein和leventhal就发现肥胖是该综合征的常见症状,但长期以来未将降体重作为该综合征肥胖病人的常规治疗方法。近年很多观察性研究资料发现减重能促进PCOS病人恢复自发排卵。一项为期15年的对照前瞻性的研究发现,减重能降低10年内糖尿病及8年内高血压的发病率;并有研究表明限制能量摄入是减重和改善生殖功能最有效的方法,甚至有时在体重仍未见明显下降时,生殖功能已得到了明显的改善,这可能与能量摄入减少有关。最早的一项关于低卡路里饮食摄入的观察性研究发现,20例肥胖的病人(14例PCOS,6个为高雄激素血症-胰岛素抵抗-黑棘皮病病人)予低卡路里饮食8个月,结果明显降低了胰岛素及雄激素水平,随后的多项研究也进一步证实此结果。有证据指出,肥胖病人予低糖饮食有益于改善其高胰岛素血症。2008年的欧洲生殖与胚胎学会/美国生殖医学会(ESHRM/ASRM)共识建议肥胖型PCOS病人首选低糖饮食。2009年国外学者对14项随机对照研究的荟萃分析的资料显示(其中仅2项研究为PCOS病人),对于肥胖者,不论是否为PCOS病人,生活方式的改变(生活习惯及饮食控制)是其一线治疗的方法。但是对不同食物结构组成对减重疗效的评估目前尚缺乏大样本研究,故不同的食物结构对控制体重的效果仍不明确。运动也是控制体重的方法之一,它可提高骨骼肌对胰岛素的敏感性,但关于单纯运动对PCOS生殖功能恢复的作用的研究很少。在一项临床小样本研究中未证实单独运动对减重有效。另外,也有采用药物减重的报道,如采用胰岛素增敏剂二甲双胍抑制食欲的作用;研究证实二甲双胍治疗肥胖型PCOS时,能使体重有一定程度的下降,并能改善生殖功能。一项应用大剂量的二甲双胍(大于1500mg/d)或服用时间大于8周治疗肥胖病人的临床研究表明,二甲双胍组比安慰剂组能明显减轻体重。但是改善生活方式联合大剂量的二甲双胍能否达到更好的协同作用尚缺乏大样本的研究。此外,对饮食运动控制饮食效果并不明显者,美国国家心肺循环研究中心及Cochrane系统综述建议如下:对于BMI大于30kg/m2且无并发症的肥胖病人或BMI大于27kg/m2并伴并发症的病人可给予西布他明食欲抑制剂治疗;而对于BMI大于40kg/m2的病人可采用手术抽脂减重。但上述方式对生殖功能的影响未见报道。2)控制月经周期疗法:由于PCOS病人长期无排卵,子宫内膜长期受雌激素的持续作用,而缺乏孕激素拮抗作用,其发生子宫内膜增生性病变,甚至子宫内膜癌的几率明显增高。定期应用孕激素或给予含低剂量雌激素的雌孕激素联合的口服避孕药(oral contraceptive pills,OCPs)能很好地控制月经周期,起到保护子宫内膜,阻止子宫内膜增生性病变的作用。并且定期应用孕激素或周期性应用COC能抑制中枢性LH的分泌,部分病人停用口服避孕药后恢复自发排卵。因此对于无排卵PCOS病人应定期采用孕激素或口服避孕药疗法以保护子宫内膜及控制月经周期,阻止因排卵功能失调引起的异常子宫出血及子宫内膜增生性病变,并可能有助于自发排卵功能的恢复。· A.单孕激素用药方法:适合于月经频发、月经稀发或闭经的病人,可采用孕激素后半周期疗法控制月经周期。用药方法:醋酸甲羟孕酮10mg/d,每次服药8~10天,总量80~100mg/周期;地屈孕酮10/d,每次服药140天,总量140mg/周期;微粒黄体酮200mg/d,每次服药10天,总量2000mg/周期。用药时间和剂量的选择根据病人失调的月经情况而定,月经频发的病人一般在下次月经前3~5天用药;月经稀发、闭经的病人应至少60天用药一次。· B.口服避孕药疗法:雌孕激素联合的口服避孕药(OCPs),如妈富隆(炔雌醇30μg+去氧孕烯150μg)、达英-35(炔雌醇35μg+环丙孕酮2mg)、优思明(炔雌醇30μg+屈螺酮3mg)等。适用于单孕激素控制周期撤药出血较多者,或月经不规则者,及月经过多病人需先用OCPs止血者。用药方法:调整周期用药方法:在采用孕激素撤药月经第5天起服用,每天1片,共服21天;撤药月经的第5天重复使用,共3~6个周期为1疗程。注意事项:OCPs不会增加PCOS病人患代谢性疾病的风险,但有血栓风险;因此,有口服避孕药禁忌证的病人禁用。3)降雄激素疗法:适用于有中重度痤疮、多毛及油脂皮肤等严重高雄激素体征需治疗的病人及循环中雄激素水平过高者。目前PCOS病人常用的降雄激素药物主要为OCPs、胰岛素增敏剂、螺内酯及氟他胺。· A.OCPs:除用于PCOS病人调整月经周期,保护子宫内膜,还能通过抑制垂体LH的合成和分泌,从而有效降低卵巢雄激素的产生,所含的雌激素成分(炔雌醇)可有效地促进肝脏合成SHBG,进而降低循环中雄激素的活性。某些OCPs所含的孕激素具抗雄激素作用,如达英-35制剂所含的环丙孕酮及优思明所含屈螺酮均具有抑制卵巢和肾上腺雄激素合成酶的活性及在外周与雄激素竞争受体,因此不仅能有效降低卵巢雄激素的生成,而且也能抑制肾上腺雄激素的产生,并可阻止雄激素的外周作用,从而有效改善高雄激素体征。另外,OCPs还通过抑制LH和雄激素水平缩小卵巢体积。由于环丙孕酮的上述抗雄激素作用为目前具抗雄激素作用孕激素之首,因而含环丙孕酮的达英-35为目前抗雄激素作用最强的OCP。用药方法:撤药月经的第5天起服用,每天1片,共服21天。用药3~6个月,50%~90%的病人痤疮可减少30%~60%,对部位深的痤疮尤为有效,服药6~9个月后能改善多毛。· B.胰岛素增敏剂:胰岛素增敏剂二甲双胍能降低循环中的胰岛素水平,进而减少卵巢及肾上腺来源的雄激素的合成,并能解除高胰岛素对肝脏合成SHBG的抑制作用,故也能有效地降低循环中雄激素水平及其活性,但其降低雄激素作用的治疗效果一般需3个月,持续服药作用持久;服药期间随着胰岛素及雄激素的下降,排卵功能可恢复。用药方法:见下述降胰岛素疗法。· C.螺内酯及氟他胺:螺内酯通过抑制17-羟化酶和17,20-裂解酶(雄激素合成所需的酶),以减少雄激素的合成和分泌;在外周与雄激素竞争受体,并能抑制5α-还原酶而阻断雄激素作用。单独使用螺内酯可使50%的PCOS病人多毛症状减少40%,亦可增加胰岛素敏感性。氟他胺则由于其抑制外周5α-还原酶而具抗雄激素作用。用药方法:螺内酯:100mg/d,应用6个月可抑制毛发生长。氟他胺:250mg,每日2次,连续使用6~12个月。不良反应及用药监测:螺内酯是排钠保钾利尿药,易导致高血钾,使用时应定期监测电解质。螺内酯和氟他胺这两种药物均有致畸作用,因此应用时一般与OCPs联合应用,或用药期间避孕。另外,由于氟他胺有肝脏毒性已较少使用。关于以上药物的降雄激素作用及安全性的研究有3项大的荟萃分析。2008年的一项荟萃分析发现,胰岛素增敏剂与OCPs在改善多毛方面的效力相当,但效果不如螺内酯及氟他胺。与此同时,另一项对12个RCT研究所做的荟萃分析发现,螺内酯联合OCPs的作用明显优于单独应用OCPs,而氟他胺联合二甲双胍的作用明显优于单独应用二甲双胍。另外,2009年的一项荟萃分析表明,在调节月经周期和降低雄激素水平上,OCPs优于二甲双胍;但二甲双胍能明显降低胰岛素和甘油三酯水平,3个月以上的长期服药可使病人胰岛素及雄激素水平下降;两者对PCOS病人空腹血糖及胆固醇的影响无统计学差异。4)胰岛素抵抗的治疗:有胰岛素抵抗的病人采用胰岛素增敏剂治疗。可降低胰岛素,从而降低循环中的雄激素水平,从而有利于排卵功能的建立及恢复,并可阻止2型糖尿病等代谢综合征的发生。在PCOS病人中常选用二甲双胍,对二甲双胍治疗不满意或已发生糖耐量损害、糖尿病者可加用噻唑烷二酮类药物(TZDs)。·A.二甲双胍:能明显改善有胰岛素拮抗的PCOS病人的排卵功能,使月经周期恢复运转和具有规律性。一项随机对照双盲临床试验证实IR是二甲双胍治疗后排卵功能恢复的预测指标。另外,二甲双胍可明显增加非肥胖型PCOS和青春期PCOS病人排卵率(A级证据)及妊娠率(B级证据),早孕期应用二甲双胍对胎儿无致畸作用(A级证据)。用法:初始剂量250~500mg/d,逐步增加至目标剂量1500~2550mg/d。不良反应及用药监测:胃肠道反应最常见,餐中服用可减轻症状。乳酸性酸中毒为罕见的严重不良反应;用药期间每3个月监测肝肾功能。·B.噻唑烷二酮类药物(TZDs):TZDs为PPARγ受体激动剂,能增强外周靶细胞(肝细胞、骨骼肌细胞、脂肪细胞)对胰岛素的敏感性,改善高胰岛素血症。罗格列酮既往是常用的TZDs,但因其心脏毒性已停用,现多选用安全性较高的吡格列酮;TZDs增加胰岛素敏感性的作用与二甲双胍相仿;对于不能耐受二甲双胍的病人,可考虑吡格列酮,或单用二甲双胍疗效不满意者可加用吡格列酮。但由于其可能的肝脏毒性及胚胎毒性,在服用TZDs期间应监测肝功能并注意避孕。(2)并发症治疗1)子宫内膜增生病变的治疗:子宫内膜增生病变的PCOS病人应选用孕激素转化子宫内膜。对于已发生子宫内膜样腺癌的病人应考虑手术治疗。2)代谢综合征的治疗:对于已出现高血压、高脂血症、糖尿病的病人,建议同时内科就诊。(3)促孕治疗:由于PCOS病人存在胰岛素抵抗,故在妊娠期发生妊娠糖尿病或妊娠期合并糖尿病、妊娠高血压、先兆子痫、妊娠糖尿病、早产及围产期胎儿死亡率的风险明显增高,故应引起重视。2008年,ESHRM/ASRM关于PCOS不育的治疗已达成共识,认为对PCOS病人采用助孕干预开始之前应该首先改善孕前状况,包括通过改善生活方式、控制饮食及适当运动降体重,以及降雄激素、降胰岛素和控制月经周期等医疗干预。部分病人可能在上述措施及医疗干预过程中恢复排卵;但在纠正高雄激素血症及胰岛素抵抗后仍未恢复排卵者可考虑药物诱发排卵。1)一线促排卵药物——氯米芬:氯米芬为PCOS的一线促排卵治疗药物,价格低廉,口服途径给药,不良反应相对小,用药监测要求不高。其机制是与雌激素竞争受体,阻断雌激素的负反馈作用,从而促进垂体FSH的释放。该药排卵率约为75%~80%,周期妊娠率约22%,6个周期累积活产率达50%~60%。肥胖、高雄激素血症、胰岛素抵抗是发生氯米芬抵抗的高危因素。用药方法及剂量:自然月经或药物撤退出血的第5天开始,初始口服剂量为50mg/d,共5天;若此剂量无效则于下一周期加量,每次增加50mg/d;最高剂量可用至150mg/d共5天,仍无排卵者为氯米芬抵抗。氯米芬抵抗的PCOS病人,可采用二甲双胍联合氯米芬治疗;7个关于二甲双胍联合氯米芬的观察性研究的荟萃分析表明,二甲双胍联合氯米芬的排卵率较单用氯米芬增加4.41倍(B级证据)。如果氯米芬在子宫和宫颈管部位有明显的抗雌激素样作用,则可采用芳香化酶抑制剂——来曲唑来进行促排卵治疗。来曲唑治疗的排卵率可达60%~70%,妊娠率达20%~27%;目前的观察性研究未见来曲唑对胚胎有不良作用,但仍需大样本研究来进一步证实来曲唑对胚胎的安全性。治疗期限:采用氯米芬治疗一般不超过6个周期。氯米芬治疗无效时,可考虑二线促排卵治疗,包括促性腺激素治疗或腹腔镜下卵巢打孔术。来曲唑:也为PCOS的一线促排卵治疗药物。其机制为:通过抑制芳香化酶的作用,阻断雄激素如雄烯二酮(A)和睾酮(T)向雌酮(E1)和E2转换,使体内雌激素降低,阻断其对下丘脑和垂体的负反馈作用,使垂体Gn分泌增加,从而促进卵泡的发育和排卵。用药方法及剂量:自然月经或药物撤退出血的第3天开始,口服剂量为2.5~5mg/d,共5天。治疗期限:一般不超过6个周期,当来曲唑治疗无效时,可考虑二线促排卵治疗,包括促性腺激素治疗或腹腔镜下卵巢打孔术。2)促性腺激素:促性腺激素促排卵治疗适用于氯米芬抵抗者,列为PCOS促排卵的二线治疗。促性腺激素促排卵分为低剂量递增方案及高剂量递减方案。较早的研究报道,上述两种方案获得单卵泡发育的成功率均较高,但是目前一项大样本的研究资料显示低剂量递增方案更为安全。低剂量递增方案促单卵泡发育排卵率可达到70%,妊娠率为20%,活产率为5.7%,而多胎妊娠率小于6%,OHSS发生率低于1%。3)腹腔镜卵巢打孔术(laparoscopic ovarian drilling,LOD):早在1935年,Stein和Leventhal首先报道了在无排卵PCOS女性采用卵巢楔形切除,术后病人的排卵率、妊娠率分别为80%和50%,但之后不少报道术后可引起盆腔粘连及卵巢功能减退,使开腹卵巢手术用于PCOS促排卵一度被废弃。随着腹腔镜微创手术的出现,腹腔镜下卵巢打孔手术(LOD)开始应用于促排卵;多项文献的研究结果认为,每侧卵巢以30~40W功率打孔,持续5秒,共4~5个孔,可获得满意排卵率及妊娠率。5项RCT的研究资料显示,对于氯米芬抵抗的PCOS病人LOD与促性腺激素两项方案对妊娠率及活产率的影响差异无统计学意义,且LOD组OHSS及多胎妊娠的发生率小于促性腺激素组。之前的研究认为,对于CC抵抗或高LH的PCOS病人可应用LOD;但是,近期的研究发现,并不是所有的CC抵抗或高LH的病人均适用于该手术。日本学者对40例PCOS不育病人进行回顾性队列研究发现,睾酮水平高于4.5nmol/L或雄激素活性指数(free androgen index,FAI)高于15、LH低于8IU/L或BMI大于35kg/m2的PCOS病人因其可能有其他致无排卵因素,故不宜采用卵巢手术诱发排卵。另外,较多的文献研究发现,LOD对胰岛素敏感性的改善无效,故卵巢手术并不适用于存在显著胰岛素抵抗的PCOS病人。4)体外受精-胚胎移植(IVF-ET): IVF-ET适用于以上方法促排卵失败或有排卵但仍未成功妊娠,或合并有盆腔因素不育的病人,为PCOS三线促孕治疗。近期的一项荟萃分析发现,在PCOS病人中采用促性腺激素超促排卵取消周期的发生率较非PCOS病人明显增高,且用药持续时间也明显增加,临床妊娠率可达35%。有一项对8个RCT的荟萃分析发现,联合应用二甲双胍能明显增加IVF的妊娠率,并减少OHSS的发生率。- +预后
相关检查
相关文章
