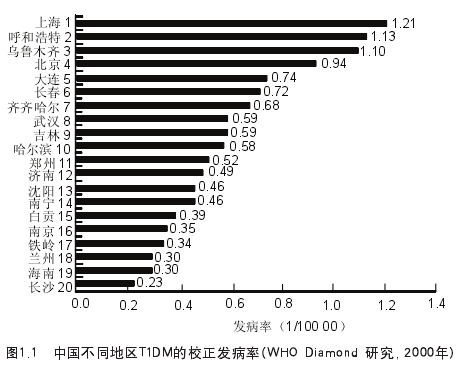
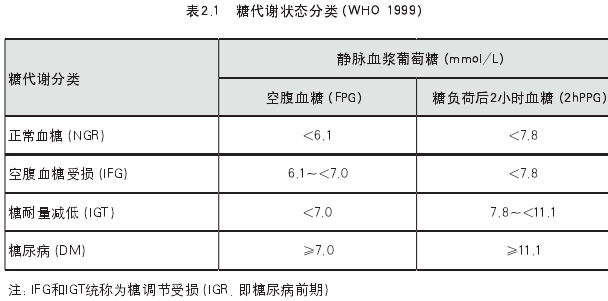
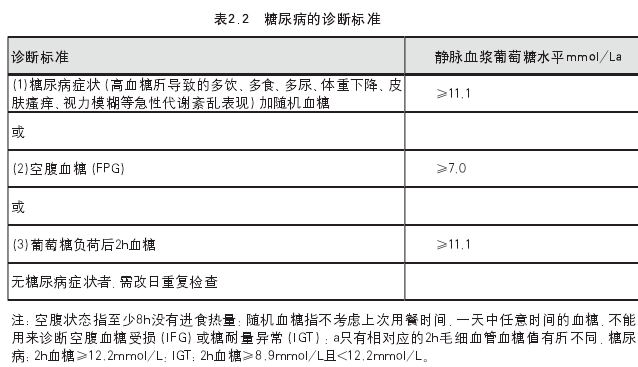
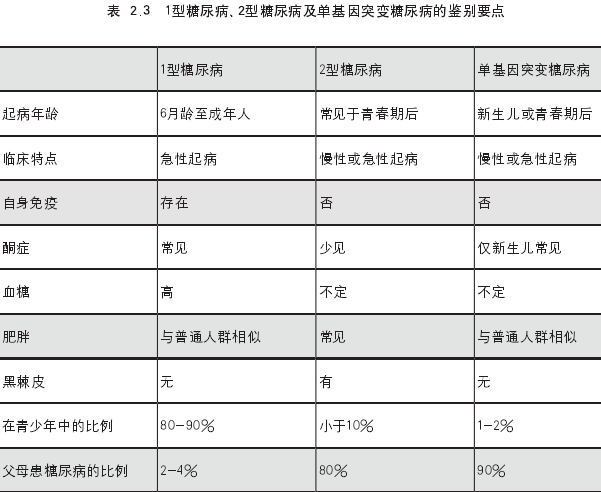
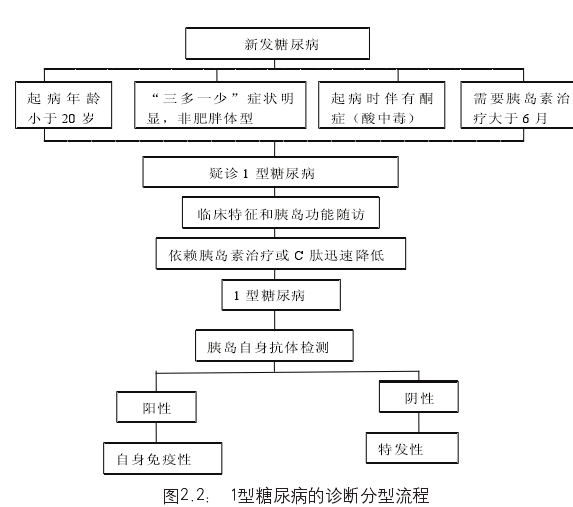
治疗:
T1DM的病因学、临床特征、治疗方案、临床预后等均具有与2型糖尿病不同的特殊性,在血糖控制目标、血糖监测以及糖尿病自我管理教育等方面需要根据患者生长发育期和社会心理期而个体化的调整。T1DM的治疗目标包括:1)避免症状性高血糖和低血糖症;2)尽早对升高的HbA1c水平进行干预;3)预防家长或孩子由于糖尿病产生的心理问题;4)预防青春期代谢恶化;5)提供积极的医疗服务和糖尿病管理知识;6)维持正常的生长与发育。
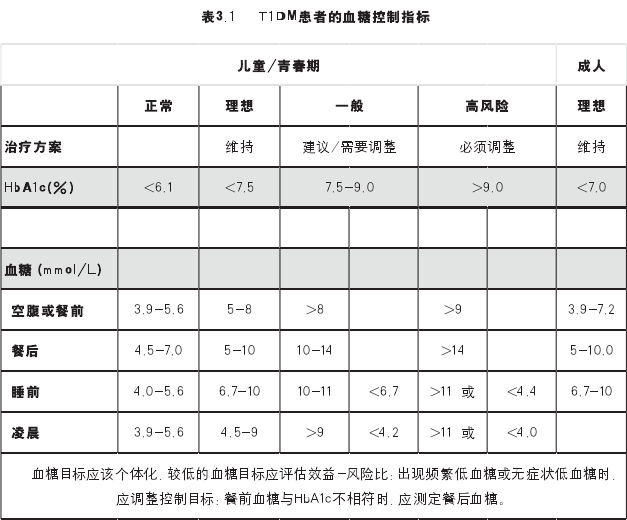
降低高血糖和防止低血糖是T1DM血糖控制的两大目标,因此目前公认的血糖控制标准为:在最少发生低血糖风险的情况下应使患者的血糖尽可能接近正常水平。对于个体患者而言,血糖控制目标的制定应考虑到以下方面:患者的年龄、患者本人或其家庭管理和认识糖尿病的能力、血糖监测频率及就诊的方便性与积极性。建议我国T1DM血糖控制目标是:在尽量避免低血糖基础上,儿童和青春期HbA1c<7.5%;成人HbA1c<7.0%;老年人Hb A1c<7.5%;不同年龄阶段的T1DM患者的血糖控制目标不同(表3.1)。
目前而言,T1DM仍然是终身性疾病。尽管适当的胰岛素治疗可以给予患者接近正常人的预期寿命,但在整个疾病过程中,除了糖尿病专科医生的指导外,T1DM患者或其亲属需要掌握饮食、运动、生长发育、血糖监测、胰岛素注射方法、急慢性并发症识别和预防以及心理调整等多个方面的知识,即应给予患者和至少一名家庭成员进行糖尿病自我管理教育(Diabetes Self-management Education,DSME)。由于T1DM患者多为儿童或青少年,因此应特别强调父母或监护人在糖尿病管理中的作用。
1.糖尿病自我管理教育的基本原则
建议一旦诊断,就应给予T1DM患者和至少一名家庭成员进行DMSE,包括:1)应根据需要随时给予个体化、有针对性的自我管理教育指导,尤其应关注学龄期、青春期、婚育期等时期生理、心理的教育和辅导。2)定期组织开展小组式的管理经验交流有助于患者的社会交流和信心培养。3)重视家庭成员对DMSE知识的掌握,对于年轻患者的糖尿病管理有重要的支持作用和意义。4)糖尿病治疗中心应建立由多专业医务人员组成的糖尿病教育和支持团队。建议由内分泌科、儿科、心理科、营养科、眼科、肾内科、产科等多个专科医生以及糖尿病专业教育护士等组成,并根据患者不同时期,不同疾病状态的需要给予相关的、持续的专业辅导。
2.血糖监测
血糖监测是将血糖安全地控制在目标范围的重要手段之一。监测血糖可以评估和反映糖代谢紊乱的程度和治疗效果,指导合理治疗方案的制定和调整。利用快速血糖仪进行床边血糖检测(Point of Care Testing,POCT)和患者自我血糖监测(Self-Monitoring of Blood Glucose, SMBG)是临床上血糖监测的基本形式;反映2-3月平均血糖水平的HbA1c是反映长期血糖控制水平的金标准;连续3-5天的动态血糖监测是在血糖波动较大患者中发现无症状低血糖和血糖波动特征的重要手段;糖化白蛋白和血、尿酮体也是反映糖代谢异常程度的有用指标。
1)POCT和SMBG:反映实时血糖水平,是临床血糖监测的基本形式。POCT是由经培训的临床医护人员对住院患者进行血糖检测,以评估病情,制定和调整治疗方案。SMBG是糖尿病自我管理的一部分,由家庭成员或患者本人在日常生活对患者进行血糖监测。可以了解饮食、运动、情绪变化、其他疾病或应激等对血糖的影响,及时发现低血糖,帮助患者更好地了解自己的疾病状态,调节自我行为干预,与医生共同制定个体化生活方式干预和优化药物治疗方案。POCT和SMBG包括血糖监测、记录、回顾和方案调整等4个方面的含义。血糖监测记录不仅作为医学判断的根据,也是探讨血糖变化原因和改善血糖控制策略的依据,只有随时回顾监测记录,及时调整血糖管理方案,POCT和SMBG才能成为良好血糖管理的基础。
循证证据已证实在采用胰岛素治疗的患者中应用SMBG能改善血糖控制、并可能减少糖尿病相关终点事件。SMBG是患者使用胰岛素治疗的必要组成部分,也是达到理想血糖控制的有效手段,建议所有T1DM患者都应坚持进行SMBG。
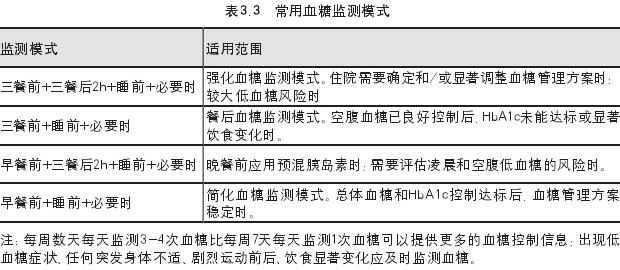
2)血糖监测时点和频率:在不同治疗阶段,可有目的地选择监测模式与频率,既可提供足够的血糖波动信息,也可减轻患者心理和经济负担。住院期间进行的POCT可以强化血糖监测,如持续的每日三餐前+三餐后+睡前;或在分阶段血糖控制原则(先控制血糖到一般水平,再控制到理想水平;先控制空腹血糖,再控制餐后血糖;先调整基础胰岛素,再调整餐前胰岛素;先避免低血糖,后控制高血糖)的基础上,灵活采用不同的血糖监测模式。基本方式为:先采取强化血糖监测模式,以评估整体血糖水平和制定合适的胰岛素治疗方案;空腹/餐前血糖较高时,采用空腹、餐前和睡前的血糖监测模式,以指导空腹和餐前血糖控制;空腹血糖控制后,采用餐后血糖监测模式,以指导餐后血糖控制;最后再次采取强化血糖监测模式,以确认血糖控制效果。特殊情况下,如生病、运动、低血糖、怀疑血糖明显增高时可随时监测血糖。
由于T1DM患者的胰岛功能差,血糖波动大,因此应特别强调餐前血糖检测的重要性,以便及时调整餐前胰岛素剂量。在患者进行SMBG时,可以根据监测时点和模式的适用范围,灵活按需地应用各种血糖监测模式。通常建议每天监测3-4次。如果条件限制,每周2-3天每天3-4次血糖监测也比每周7天每天监测1次血糖可以提供更多的血糖控制信息。各时间点血糖监测和常用血糖监测模式的适用范围可参见表3.2和表3.3。
3)采血部位:由于指尖毛血管血最能反映血糖的最新水平,POCT和SMBG的主要采血部位是指尖。但对于年轻的T1DM患者,由于恐惧和疼痛,频繁的指尖采血依从性较低,可以考虑选择避开血管的替代部位。可替代部位是手掌的大、小鱼际部位,所检测的血糖结果与指尖血糖相近,大部分时间都可以在此部位采血,代替指尖。
3.HbA1c:
HbA1c反映2-3月平均血糖水平,是反映长期血糖控制水平的金标准,但存在不能精确反映患者低血糖的风险和不能反映血糖波动特征的局限性。来自DCCT研究的循证证据显示以降低HbA1c为目标的强化治疗可以降低T1DM患者慢性并发症危险。
IDF/ISPAD建议所有年龄段的患者HbA1c控制目标均是<7.5%;ADA建议的控制目标根据年龄组而有所不同,介于7.0-8.5%之间。两个指南都同时强调个体化和尽可能避免低血糖前提下控制血糖达标。本指南建议在避免低血糖和个体化的基础上,Hb A1c的控制目标是儿童和青春期<7.5%,成人<7.0%。值得注意的是,HbA1c测定应采用标准化的检测方法。测定频率年幼儿童应每年监测6次,年龄较大的儿童应每年监测3-4次,条件限制时,每个儿童患者应该至少每六个月检测一次。
4.连续血糖监测(Continuous Glucose Monitoring, CGM)
通过监测皮下组织间液葡萄糖浓度反映血糖水平,提供连续、全天的血糖信息,有助于了解连续数天血糖波动的趋势,发现不易被上述血糖监测方法所检测的高血糖和低血糖,尤其对发现无症状低血糖可能有益。采用连续血糖监测可以在减少低血糖风险情况下,将血糖和HbA1c控制到接近正常的水平。血糖波动大、反复低血糖、无症状性低血糖、或者无法解释的高血糖患者应进行CGM监测。
5.血、尿酮
反映严重糖代谢紊乱的重要监测指标。目前可用的监测方法包括尿酮(乙酰乙酸)、血酮(β-羟丁酸)。如果可能,最好监测血酮,尤其是留取尿样本较为困难的年幼患者。
在下列情况下应该监测酮体水平:1.伴有发热和/或呕吐的疾病期间;2.持续血糖≥14mmol/L时;3.持续多尿伴血糖升高,尤其出现腹痛或呼吸加快时。过夜空腹的血酮正常值为<0.6mmol/L,当血酮>3.0mmol/L时,高度提示存在酸中毒可能,须密切监测生命体征、血糖,必要时监测血PH值、电解质等。
因条件限制,只有尿酮测试应可用时,在以下情况下就应进行尿酮测试:伴有发热和/或呕吐的疾病期间;持续多尿伴血糖升高(>14mmol/L)。应该注意的是,T1DM患者在空腹、低碳水化合物饮食、持续运动锻炼、妊娠期间肠胃炎及酒精中毒时,血、尿酮水平会出现生理性升高。因此发现尿酮阳性和血酮升高时,在给予或调整胰岛素治疗之前,必须先监测血糖,如血糖正常或偏低,不应增加胰岛素剂量。
6.胰岛素注射和胰岛素泵的教育管理
T1DM患者由于胰岛功能基本丧失,必须终身采用胰岛素治疗维持生命和控制高血糖。患者应正确掌握胰岛素自我注射的方法和技术,如胰岛素的保管、胰岛素注射方法和装置以及注射技术等。目前,胰岛素给药途径只有静脉注射和皮下注射。各级医护人员和患者必须明确只有短效胰岛素和特定的速效胰岛素类似物可以静脉注射。长效、中效、预混胰岛素和速效胰岛素类似物只能皮下注射。
胰岛素注射装置包括普通胰岛素注射器、胰岛素注射用笔和胰岛素泵。可以根据患者个人需要和经济状况进行选择。目前的胰岛素注射用笔和胰岛素泵只能用于皮下注射;中长效和预混胰岛素不能用于胰岛素泵治疗。
胰岛素注射装置的合理选择和正确的胰岛素注射技术是保证胰岛素治疗效果的重要环节。所有T1DM患者都应接受与胰岛素注射技术相关的教育。包括:注射治疗的方案;胰岛素基本知识(如胰岛素保管、使用前的混匀等);注射装置的正确使用和管理(如一次性和多次性注射器的使用方法、胰岛素注射用笔芯的更换等);注射部位的选择、护理及自我检查;正确的注射技术(包括注射部位的选择、轮换、注射角度及捏皮的合理运用);注射相关并发症的识别及其预防;选择长度合适的针头;注射器和针头使用后的安全处置等。
注射部位的选择:应选取皮下脂肪丰富的部位,这些部位包括腹部、大腿外侧、上臂外侧和臂部外上侧。在腹部,应避免以脐部为圆心,半径2.5cm的圆形区域内注射。大腿注射选择其上端外侧,上臂注射可选择侧面或者后侧部位。超短效胰岛素类似物的吸收速率不受注射部位的影响,可以在以上任何注射部位给药;短效胰岛素在腹部的吸收速度较快,注射部位首选腹部;中效和长效胰岛素作为基础胰岛素时,其首选注射部位是大腿和臀部。但由于皮下组织厚度可因年龄、性别、身体部位和体重指数的不同而有很大差异,注射时也应避免肌肉注射风险。
注射步骤:注射前洗手,在院外通常不需要消毒注射部位;如注射部位不洁净,或者患者处于感染易于传播的环境,注射前应用酒精消毒注射部位。待酒精消毒处干燥后,检查胰岛素及选择注射部位。如使用预混胰岛素前需充分混匀,遵循“每天同一时间,注射同一部位”“每天不同时间,注射不同部位”或“左右轮换”的规定。儿童及青少年患者应使用长度为4-6mm的针头。身材较瘦或选择四肢部位进行注射的患者,尤其当选用5或6mm的针头时,需捏起皮肤形成皮褶后,或采取呈45°角进针注射。正确安装胰岛素笔用针头,排尽笔芯内空气,快速进针,缓慢注液,拔出针头前至少停留10秒,药物剂量较大时,停留时间可适当延长,最后将针头套上针帽放入专用废弃容器内再丢弃。
使用胰岛素泵的患者,应学会对胰岛素泵的规范管理,包括了解胰岛素泵工作原理和注意事项;做好用泵前的物品准备;保证有备用的胰岛素泵耗材;学习胰岛素泵等相关知识的培训;学习程序和输液管操作;学习胰岛素泵报警处理流程;记录基础输注率和餐前大剂量数值;注意个人清洁卫生与皮肤清洁;每天自检输液管系统1-2次;胰岛素需提前从冰箱取出,与室温同温时放入泵中;使用与泵匹配的储药器和输液管;定期与医生讨论血糖检测结果,调整胰岛素剂量等。
一、胰岛素的种类和剂型
1.胰岛素:短效胰岛素,也称常规胰岛素;中效胰岛素,如中性鱼精蛋白胰岛素。长效胰岛素,如鱼精蛋白锌胰岛素。
2.胰岛素类似物:速效胰岛素类似物,包括赖脯胰岛素、门冬胰岛素和谷赖胰岛素。长效胰岛素类似物,目前国内有甘精胰岛素和地特胰岛素。
常规胰岛素是目前广泛使用的静脉输注胰岛素剂型,速效胰岛素类似物可静脉输注,但评估和注意事项较多,未被广泛推荐。中效胰岛素、长效胰岛素及其类似物只能用于皮下注射,不能用于静脉输注(表1)。
二、T1DM胰岛素治疗原则
1.T1DM 患者因自身胰岛素分泌绝对缺乏,完全或部分需要外源性胰岛素替代以维持体内糖代谢平衡和生存。
2.T1DM患者胰岛功能差,需要通过外源性胰岛素以模拟生理性胰岛素分泌方式进行胰岛素补充,基础加餐时胰岛素治疗是T1DM首选胰岛素治疗方案。
3.应用基础加餐时胰岛素替代治疗,尽可能避免低血糖的前提下使血糖达标,能够降低T1DM远期并发症发生率。
4.建议胰岛素治疗方案应个体化,方案的制定需兼顾胰岛功能状态、血糖控制目标、血糖波动幅度与低血糖发生风险。
5.基础加餐时胰岛素替代治疗方法包括每日多次胰岛素注射(multiple daily injection,MDI)和持续皮下胰岛素输注(CSII)。
三、T1DM胰岛素治疗方案
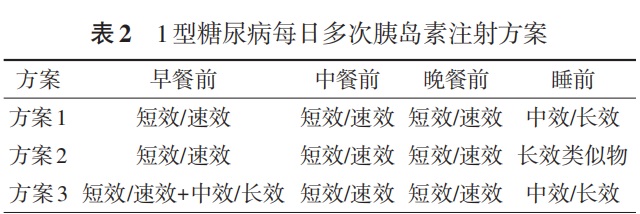
(一)MDI
基础胰岛素可通过中效胰岛素、长效胰岛素或长效胰岛素类似物给予,餐时胰岛素可通过短效胰岛素、或速效胰岛素类似物给予(表2)。与中效胰岛素相比,长效胰岛素类似物空腹血糖控制更好,夜间低血糖发生风险更低。
(二)CSII
1.采用人工智能控制的胰岛素输入装置,持续皮下胰岛素输注短效胰岛素或速效胰岛素类似物提供基础和餐时胰岛素,可模拟生理性胰岛素分泌模式。
2.中效胰岛素、长效胰岛素、长效胰岛素类似物及预混胰岛素不能用于持续皮下胰岛素输注。
3.速效胰岛素类似物吸收快、起效迅速,在持续皮下胰岛素输注中更具优势。
4. 胰岛素泵使用适应证:(1)MDI 方案血糖控制不理想者;(2)频发低血糖和/或发生无症状低血糖者;(3)妊娠糖尿病患者;(4)对胰岛素极度敏感者(胰岛素泵比皮下注射更精确);(5)既往发生过黎明现象者(此类患者可通过提高基础胰岛素量来对抗清晨高血糖);(6)因神经病变、肾病、视网膜病变等糖尿病并发症或根据病情需要加强血糖管理者;(7)实施MDI方案的患者有意愿且有良好的自我管理能力者,包括频繁的自我血糖监测、碳水化合物计算、胰岛素剂量调整。
四、胰岛素初始剂量
(一)MDI方案
1.初始MDI 方案:
(1)体重在成年理想体重正负20%以内的T1DM,若无特殊情况每日胰岛素需要总量 0.4~0.8 U/kg,每日总量也可以最小剂量12~18 U 起始;儿童根据年龄、体重及血糖情况酌情处理。
(2)每日胰岛素基础量=全天胰岛素总量×(40%~60%),长效胰岛素一般1次注射,中效胰岛素可每日 1 次或每日 2 次注射。
(3)每日餐时量一般按餐时总量的 35%、30%、35%分配在早中晚餐前。
2.CSII方案改换MDI方案:
(1)1天胰岛素总量(U)=现用胰岛素剂量总和(U)(部分患者每日胰岛素总剂量需要增加10%~20%)。
(2)3次餐前短效或速效胰岛素加睡前1次中效胰岛素治疗方案:早餐前胰岛素剂量=CSII早餐前大剂量+早餐前至午餐前的基础输注率总和,中餐前胰岛素剂量=CSII中餐前大剂量+中餐前至晚餐前的基础输注率总和,晚餐前胰岛素剂量=CSII晚餐前大剂量+晚餐前至睡前的基础输注率总和,睡前中效胰岛素剂量=睡前至次日早餐前的基础输注率总和。
(3)3 次餐前短效或速效胰岛素加睡前 1 次长效胰岛素类似物治疗方案:早餐前胰岛素剂量=CSII早餐前大剂量,中餐前胰岛素剂量=CSII中餐前大剂量,晚餐前胰岛素剂量=CSII晚餐前大剂量,睡前长效胰岛素类似物剂量大约相当于 CSII 全天基础输注率总和。
(4)3次餐前短效或速效胰岛素,早餐前及睡前各加1次中效胰岛素治疗方案:早餐前胰岛素剂量=CSII早餐前大剂量,早餐前中效胰岛素剂量=CSII早餐前至晚餐前胰岛素的基础输注率总和,中餐前胰岛素剂量=CSII中餐前大剂量,晚餐前胰岛素剂量=CSII晚餐前大剂量+晚餐前至睡前的基础输注率总和,睡前中效胰岛素剂量=睡前至次日早餐前的基础输注率总和。
(二)CSII方案
(1)初始CSII方案的患者1天胰岛素总量(U)=体重(kg)×(0.4~0.5)U/kg;
(2)由MDI转换为CSII方案:MDI方案的患者1天胰岛素总量(U)=用泵前胰岛素用量(U)×(70%~100%);
(3)每日基础量=全天胰岛素总量×(60%~40%),T1DM 常规分为 6 或更多个时间段,以尽量减少或避免低血糖事件,或根据血糖情况分段设置基础输注率;
(4)餐时追加量=全天胰岛素总量×(40%~60%),根据早中晚三餐比例一般按 1/3、1/3、1/3 或 1/5、2/5、2/5 分配,之后根据血糖监测结果调整。
五、特殊情况下的胰岛素治疗T1DM
自然病程中胰岛功能衰竭速度存在个体差异,胰岛素治疗根据患者胰岛功能的衰竭程度和对胰岛素的敏感性差异,遵循个体化原则。
(一)T1DM蜜月期
1. 初诊 T1DM 患者经胰岛素规范治疗后可出现受损的胰岛功能部分缓解期,可短期停用胰岛素,或每日使用很少量胰岛素治疗,其血糖水平也能维持在接近正常或正常的范围内,此阶段称为T1DM蜜月期。在此阶段根据血糖监测情况,可每日≤3次小剂量胰岛素(包括预混胰岛素)注射,但应以维持血糖达标为准。
2.T1DM 蜜月期仍应进行血糖监测,对于出现血糖波动大、血糖不易控制,需频繁调整胰岛素用量者建议及时评估患者胰岛功能并及时改用胰岛素强化治疗方案。
(二)脆性糖尿病阶段
1. 脆性糖尿病阶段是指由于胰岛 β 细胞功能完全衰竭,出现血糖巨幅波动,高血糖与低血糖同日内交替出现,频发不可预知的严重低血糖;可发生酮症酸中毒;糖尿病急慢性并发症的发生率及糖尿病相关的死亡率均较高。一定病程后T1DM可进入脆性糖尿病阶段,少数进展迅速的T1DM在确诊时即可进入脆性糖尿病阶段。
2. 脆性糖尿病阶段的胰岛素治疗,建议使用CSII 方案,或速效胰岛素类似物联合长效胰岛素类似物方案。联合应用非促泌剂类的口服药可能有助于减轻血糖波动,但尚缺少临床证据。
(三)儿童青少年T1DM
1.儿童青少年T1DM可采用短效胰岛素、中效胰岛素或长效胰岛素进行方案组合,近年来也有部分胰岛素类似物被中国食品药品监督管理局(CFDA)批准用于儿童和青少年糖尿病的治疗,包括门冬胰岛素(2 岁以上)、赖脯胰岛素(12 岁以上)、地特胰岛素(6岁以上)和甘精胰岛素(6~18岁适应证获批过程中)。
2.因特殊情况无法坚持基础加餐时胰岛素治疗方案的儿童青少年患者,如短期使用预混胰岛素治疗,必须加强血糖监测、及时根据血糖情况重新调整胰岛素治疗方案,避免长期血糖不达标带来的各种急、慢性并发症。
3.青春期患者为维持正常生长发育,应保证足够能量摄入,此时可适当增加胰岛素用量。
4.进入青春期后,体内性激素、生长激素等胰岛素拮抗激素分泌增多,胰岛素需要量增加;血糖水平较青春期前明显升高且波动较大,需要加强血糖监测,适时调整胰岛素治疗方案。
(四)T1DM合并妊娠
1.T1DM 合并妊娠可采用短效胰岛素、中效胰岛素或长效胰岛素进行方案组合,或使用胰岛泵治疗。目前经 CFDA 批准可用于妊娠糖尿病和糖尿病合并妊娠患者的胰岛素类似物制剂是门冬胰岛素和地特胰岛素。
2.T1DM 女性患者无论在妊娠前、妊娠期及产后都应保证充足的营养和良好的血糖控制。
3.妊娠时胎盘分泌的孕激素、雌激素有拮抗胰岛素作用,胎盘分泌的胰岛素酶使血液中胰岛素水平和活性降低,妊娠中后期胰岛素需要量,尤其是日间胰岛素需要量增加。随着胎盘娩出,拮抗胰岛素的激素及破坏胰岛素的酶急剧减少或消失,分娩后患者胰岛素的需要量快速减少,一般分娩后2~3 d胰岛素可减量至原量的1/3~1/2。
(五)其他特殊情况
1.T1DM 超重或肥胖者存在胰岛素抵抗,胰岛素需要量增加,必要时可联合二甲双胍(10岁以下儿童禁用)。
2.T1DM 合并感染和处于应急状态时,胰岛素需要量增加。
3.T1DM 患者禁食时,仍然需要基础胰岛素补充,之后根据进食和血糖逐渐恢复并调整餐时胰岛素。
4.肾功能衰竭者根据血糖监测结果适当减少胰岛素用量。
六、影响胰岛素作用的因素
(一)影响胰岛素作用的常见因素
若患者血糖控制不理想,应考虑下列因素的可能:(1)注射方法和注射部位是否正确;(2)自我血糖监测是否规范;(3)自我管理意识和技巧;(4)生活方式尤其是饮食和运动不规律;(5)心理与社会心理困境;(6)其他可能的原因,如胃轻瘫等。
(二)影响胰岛素作用的其他因素
1.拮抗胰岛素作用的因素
(1)糖皮质激素、促肾上腺皮质激素、胰高血糖素、雌激素、口服避孕药、甲状腺素、肾上腺素、噻嗪类利尿剂、苯妥英钠等可升高血糖浓度,合用时应调整胰岛素用量;(2)某些钙通道阻滞剂如可乐定、丹那唑、生长激素、肝素、H2受体拮抗剂、吗啡等药物可改变糖代谢,使血糖升高,因此与上述药物合用时,胰岛素应适当加量;(3)吸烟可通过释放儿茶酚胺而拮抗胰岛素的降糖作用,还能减少皮肤对胰岛素的吸收,因此吸烟的T1DM患者突然戒烟时应适当减少胰岛素用量。
2.协同胰岛素作用的因素
(1)雄激素、单胺氧化酶或抑制剂可增强胰岛素的降糖作用;
(2)抗凝血药物、水杨酸盐、磺胺类药及抗肿瘤药物甲氨蝶呤等可与胰岛素竞争结合血浆蛋白,从而使血液中游离胰岛素水平增高;
(3)中等量至大量的乙醇可增强胰岛素引起的低血糖作用,引起严重、持续的低血糖,在空腹或肝糖原贮备较少的情况下更易发生;
(4)奎尼丁、氯喹、奎宁等可延缓胰岛素的降解,使血中胰岛素浓度升高从而加强其降糖作用;
(5)血管紧张素转化酶抑制剂、溴隐亭、氯贝特、酮康唑、锂、茶碱、甲苯咪唑可通过不同方式直接或间接影响致血糖降低,胰岛素同上述药物合用时应适当减量;
(6)奥曲肽可抑制生长激素、胰高血糖素及胰岛素的分泌,并使胃排空延迟及胃肠道蠕动减缓,引起食物吸收延迟,从而降低餐后高血糖,在开始使用奥曲肽时,胰岛素应适量减量,以后再根据血糖调整。
一、医学营养治疗的目标与原则
T1DM患者医学营养治疗的目标是通过科学的饮食管理,保证患者的正常生活和生长发育,纠正代谢紊乱,延缓并减轻糖尿病并发症的发生和发展,提高生活质量。具体原则为:1)通过日常食物的合理搭配来维持膳食营养平衡,保证各种所需的营养素;2)纠正代谢紊乱:通过平衡饮食与合理营养,以控制血糖、补充优质蛋白质和预防其它必需营养素缺乏,确保患儿维持最佳生长和发育过程;3)通过调整能量的摄入与消耗来保持适宜的体重及腰围;4)选择适当的食物品种和进食方式以减少血糖的波动,并预防各种急、慢性并发症;5)养成维持终生健康的饮食习惯并提高生活质量,改善整体健康水平。
二、能量
糖尿病饮食治疗中的“总量控制”原则是指需针对患者每日所摄入的食物总能量进行控制,通过对食物能量摄入的控制可调控患者的体重、改善胰岛素敏感性,对饮食治疗效果起到决定性的作用。成年T1DM患者基本能量的摄入水平按每公斤理想体重25-30kcal/d计算,再根据患者的体型、体力活动量及应激状况等调整为个体化的能量推荐值,其中体力活动量和应激状况为影响实际能量消耗的两个主要因素。儿童T1DM患者全日能量摄入的计算可采用下面公式:总热量(kcal)=1000+年龄×(100~70)(括号中的系数100~70即1~3岁儿童按100,3~6岁按90,7~10岁按80,大于10岁者按70分别计算)。
无论是成人还是儿童T1DM患者,当实际能量摄入与推荐能量摄入之间的数值存在较大差距时,均应采取逐步调整的方式使实际摄入量达到推荐摄入量;其中患者体重变化可作为其阶段性(三个月)能量出入平衡判断的实用参考指标。
成年T1DM患者三大生热营养素占总能量的推荐比例与健康成年人基本相同;但减体重的糖尿病饮食因其总热量受到了更为严格的控制,其蛋白质所占总热量的比例可适当提高;糖尿病肾病患者的蛋白质提供比例宜相对偏低;学龄前儿童患者三大生热营养素的比例可参照同龄健康儿童膳食营养素参考摄入量执行;不推荐T1DM患者长期接受极低能量(<800kcal/d)的营养治疗,既不利于长期的体重控制,也很难达到均衡营养的要求。
三、蛋白质
肾功能正常的成年T1DM患者,推荐膳食蛋白质摄入量与健康成年人基本相同,一般可占总能量比例的10-15%或以每公斤标准体重1g为宜,但所占总能量比例最高不超过20%;妊娠、儿童患者的膳食蛋白质摄入水平应适当提高,早、中、晚期妊娠妇女每天应比同龄非妊娠妇女分别增加5-10g、15-20g及20-25g;不同年龄阶段的儿童及少年膳食蛋白质摄入应分别达到每天每公斤理想体重1.5-3.5g。高蛋白质膳食可能导致酮血症,而高蛋白质/低碳水化合物的膳食结构对儿童和少年生长发育不利,应当注意避免。
已发生糖尿病肾病的患者,其膳食蛋白质应以优质蛋白质为主,每日的摄入量应不低于每公斤理想体重0.8g,否则容易发生蛋白质营养不良;而膳食蛋白质摄入过量,可加重已有持续蛋白尿或肾病病人的肾功能损害,但对肾功能正常的T1DM患者而言,尚缺乏相应的安全性和有效性的临床证据。
四、脂肪
中国居民膳食指南推荐脂肪应占全日总能量比例的20-30%;推荐人均居民烹调油的用量应小于25g/日。较低的膳食脂肪摄入量(如占总能量10%左右)可改善糖尿病患者胰岛素敏感性,但缺乏可操作性。膳食脂肪的主要来源是食物脂肪和烹调用油,因此控制高脂肪性食物如肥肉、坚果、糕点、油炸食物和烹调用油量的摄取是控制脂肪摄入的关键,在外就餐也是导致脂肪摄入增加的重要因素。脂肪摄入量的增加虽然对餐后血糖水平影响较小,但不利于长期的血糖控制、血脂异常和心血管并发症的预防以及胰岛素敏感性的改善。
膳食脂肪中的脂肪酸组成对改善病人血脂异常及预防心血管并发症有益,推荐的膳食脂肪组成包括:饱和脂肪酸及反式脂肪酸占每日总能量比例应小于10%,单不饱和脂肪酸的比例应在10-20%,多不饱和脂肪酸的比例应小于10%。
饱和脂肪酸升高LDL-c的作用非常明显;反式脂肪酸不但升高LDL-c,而且降低HDL-c的作用,致心血管疾病的作用更强;因此应限制摄入含饱和脂肪酸为主的动物脂肪如牛油、猪油等以及含反式脂肪酸的人造奶牛、冰激凌、奶茶、糕点、饼干等。
单不饱和脂肪酸有改善血脂异常和有助于改善糖耐量,橄榄油、茶籽油、菜籽油等植物油以及山核桃、大杏仁、蚕蛹、鸭油等脂肪中单不饱和脂肪酸含量较多(占总脂肪含量的50%以上)。虽然单不饱和脂肪酸可以改善病人代谢状况,但不应因增加单不饱和脂肪酸摄入而使总脂肪摄入过量。
多不饱和脂肪酸中的ω-3脂肪酸具有降低血胆固醇和降血压等作用;建议膳食中应注意增加ω-3脂肪酸的摄入,如多脂海鱼、坚果、绿叶蔬菜等食物以及橄榄油、茶籽油、沙棘油、紫苏油等。每周吃2次海鱼是有益的;与此同时,应限制胆固醇摄入,每天不超过300mg。
五、碳水化合物
2007版的中国居民膳食指南建议由碳水化合物所提供的能量比例应占55-65%,糖尿病患者的比例可略低,即50-60%;除2岁内的儿童外,碳水化合物应主要来自全谷类、豆类、蔬菜、水果及乳类食物;极低碳水化合物膳食可导致脂质代谢异常,不推荐使用;成年T1DM患者每天碳水化合物总量不应低于130g。
碳水化合物是影响血糖水平的主要营养素,对于T1DM患者而言,应根据碳水化合物的种类和数量来初步确定胰岛素剂量。通常的饮食管理模式推荐固定种类和数量的碳水化合物,以减少血糖波动,适合于自我管理能力较差、对糖尿病知识欠缺的患者。更为灵活的饮食管理模式为碳水化合物计数(carbohydrate counting)方式,即通过计算摄入食物中碳水化合物的量来相对准确地估算餐前胰岛素用量,这种方式要求患者具有较好的自我管理能力。精准的食物碳水化合物计算通常需要在专业营养师的指导下进行;临床医师、护师或患者可以借助食物交换份表中各类食物碳水化合物含量大致判断所摄入食物中碳水化合物的总量。根据多数病人的实际应用,一般每10-15g碳水化合物需要使用1个单位的速效胰岛素;但具体到每个病人可能因个体对胰岛素敏感性不同而有较大差异,需要病人在实践中进行反复摸索、调整。碳水化合物计数最大的好处是不必过分限制食物种类和食量也同样能管理好血糖。
在选择碳水化合物的种类时,要关注其血糖生成指数(glycemic index, GI)。 低GI食物可减少餐后血糖水平的波动,例如未经加工的全谷、粗杂粮、豆类以及含膳食纤维丰富的食物如麸皮、豆渣等,推荐在食物选择中注意搭配。尽管低GI食物升高餐后血糖水平的幅度较小,但过量摄入同样可导致血糖水平增高;相反即便是高GI食物,如果能严格控制摄入量,则对进食后血糖水平的影响也不会太大。纯碳水化合物类食物如淀粉、果糖、蔗糖和酒精等过量摄入可能对血脂特别是对甘油三酯的改善不利,故应注意避免。糖尿病患者可以选择蔗糖作为甜味剂,但应将其所提供的热量纳入全天摄入热量之内进行计算,且总量不应超过25g。建议患者使用低GI的糖醇如木糖醇、麦芽糖醇等或无热量的甜味剂如甜蜜素、甜味素、甜菊苷等代替蔗糖。长期的高纤维膳食有助于改善糖尿病患者血糖水平,应保证12-14g/1000kcal的摄入量,膳食纤维主要来自全谷类食物、豆类和蔬菜。因此,提倡用粗杂粮代替部分精细粮。
酒精可抑制糖原分解和糖异生作用,同时也可抑制糖的利用,对血糖控制不利;同时也易引起微量营养素(钙、锌、水溶性维生素等)的消耗与丢失增加,导致脂肪、糖等代谢异常,故应避免。T1DM患者若有饮酒要求,建议成年患者每日应少于1个酒精单位。1个酒精单位相当于啤酒285毫升,或葡萄酒100毫升,或白酒30毫升。
六、无机盐及微量元素
病情未得到控制的糖尿病患者几乎都会出现无机盐代谢的负平衡,且病情越重这种负平衡的现象也越明显。糖尿病患者最常发生钙、镁及微量元素硒、锌、铁等元素的负平衡。但在通常情况下,患者没有必要额外补充无机盐及微量元素制剂,通过合理的食物搭配同样可以满足病人的营养代谢需要。只有当饮食摄入无法达到膳食推荐摄入量时,可以适当补充。
钠的过量摄入既不利于血压控制也对血糖的稳定性有间接影响,特别是对伴有心衰、水肿的病人极为不利,因此,建议这类糖尿病患者每日钠的摄入量应限制在2g/d以内,除日常食物钠外,由食盐提供的钠折合食盐量约3g。即便是没有心、肾并发症的病人,每日食盐消耗量也应控制在6g以内。
七、维生素
病情未得到控制的T1DM患者一般存在维生素特别是水溶性维生素的负平衡或缺乏,可以在代谢控制不佳时根据患者情况给予短期补充。目前缺乏长期大量补充抗氧化维生素安全性的报告,因此不推荐患者常规大量补充这类维生素。
八、妊娠期的医学营养治疗
妊娠期的饮食管理包括个体化的产前饮食计划,以优化血糖控制效果。怀孕期间,应根据孕妇的饮食习惯以及血糖情况确定能量和碳水化合物的摄入。强调应进行血糖监测和每日饮食记录,用于调整胰岛素剂量和饮食计划。具体原则包括:1)应采用营养治疗、血糖监测以及胰岛素治疗等综合措施控制血糖;2)怀孕期间,建议能量摄入充足以保证适宜的体重增加,在此期间不建议减轻体重;每天应至少摄入175g碳水化合物;3)应避免酮症酸中毒或饥饿性酮症引起的酮血症;4)少量多餐有助于血糖控制,并减少低血糖风险;5)在孕前和妊娠早期补充含0.4-1.0mg叶酸的多种维生素补充剂,以降低糖尿病母亲子代中发生神经管缺陷性疾病;6)宣传母乳喂养,使糖尿病妇女了解如何应对哺乳所引起的血糖水平变化,一般而言,哺乳期所需要的胰岛素会减少,应根据血糖监测结果进行调整。
一、运动对T1DM患者的益处
1.有助于血糖控制。
2.可促进血液循环、改善心肺功能、增强身体灵活度。
3.有规律的负重运动如球类运动、跳跃运动、体操等可增加骨密度,有利于生长发育。
4.有利于放松紧张情绪,增强适应性、幸福感和团队参与意识及社会认同感等。
二、运动治疗的适应症及禁忌症
1.运动治疗的适应症:病情稳定的患者均应参加多种形式的有氧运动。
2.运动治疗的禁忌症:1)合并各种急性感染;2)酮症或酮症酸中毒未纠正;3)空腹或餐前血糖>13.9mmol/L;4)频发低血糖时;5)严重的糖尿病肾病、严重的糖尿病视网膜病变及严重的糖尿病神经病变及有心血管疾病风险未控制的患者。
三、运动前的准备
1.全面体检:在开始制定运动计划之前,均应进行全面的体检以筛查潜在的并发症,避免疾病或损伤,去除危险因素、以确保运动安全。检查内容包括:血糖、糖化血红蛋白、血脂、血压、心率、心电图、眼底、尿常规、尿微量白蛋白、足部和关节、神经系统等。
2.制定运动方案:根据体检结果全面评估患者情况,制定个体化的运动计划,包括运动方式、强度、时间及频率等。
3.选择安全的运动场地,合适的鞋袜等运动装备。
4.随身携带含碳水化合物的食品、无糖饮料及糖尿病保健卡,以备自救。
四、运动的方式、强度、时间和频率
1.运动方式与强度
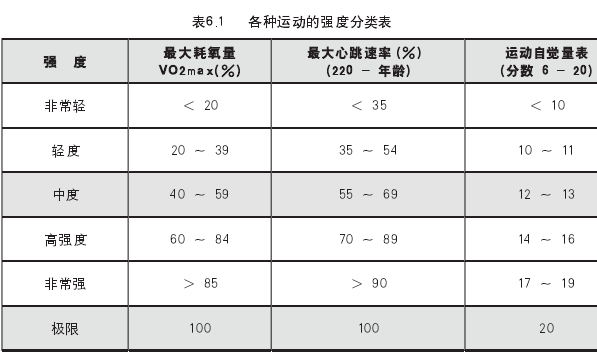
糖尿病患者可选择轻—中等或稍强度的有氧运动方式,轻度有氧运动包括购物、散步、做操、太极拳、气功等;中度运动包括快走、慢跑、骑车、爬楼梯、健身操等;稍强度运动包括跳绳、爬山、游泳、球类、舞蹈等。糖尿病患者的运动强度以最大运动强度的60%-70%为宜,通常用心率或自身感觉来衡量运动强度。糖尿病患者运动强度应保持心率(次/min)=(220-年龄)×60-70%或运动时感觉全身发热,出汗,但非大汗淋漓。各种运动强度参见表6.1。
2.运动的时间与频率
开始运动的时间一般在餐后1.5h,每天至少一次;每次运动的时间约30-60min,包括运动时5-10min的热身运动及结束前的10min的整理运动,达到中等运动量的时间持续约30min;对尚无运动习惯的患者,缓慢逐步达到每天至少30min中度运动强度,若不能一次运动30min,可分次进行,每次10-15min。
五、运动治疗的注意事项
1.运动的原则为循序渐进、量力而行、持之以恒,在保证安全的前提下进行。
2.预防低血糖
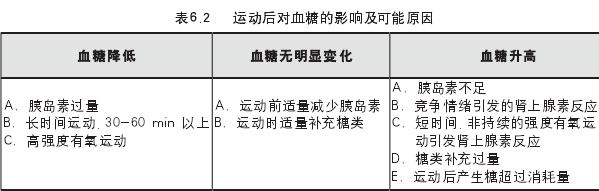
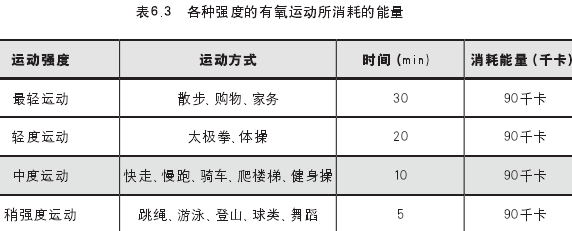
T1DM患者及其家人、学校和幼儿园老师应了解运动可能导致低血糖、知晓如何预防、识别和处理低血糖。运动对血糖的影响与运动类型、持续时间以及个体对激素变化的反应性等有关,每公斤体重每小时运动大概会消耗1-1.5克碳水化合物,参见表6.2和表6.3。
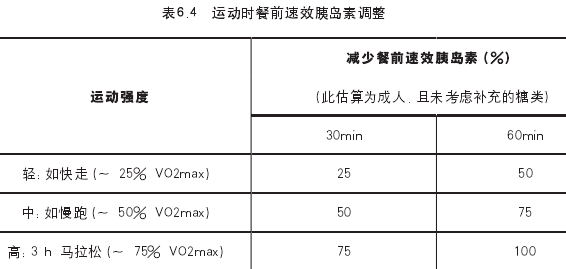
尤其要预防运动中及运动后低血糖:运动后低血糖多见于青春期少年,运动后低血糖甚至可延迟至24h后发生。1)运动前、运动后应监测血糖,必要时加测运动中血糖,以评估减少胰岛素的剂量及在何种情况下应额外补充碳水化合物以避免高强度运动时低血糖;2)若运动前血糖<7.0mmol/L,应额外补充碳水化合物;运动前把胰岛素减少25-50%;若不能监测血糖,可在运动前增加含碳水化合物的食物,并减少胰岛素剂量;3)注射胰岛素后1-1.5h是胰岛素作用高峰,此时应避免剧烈运动;避免把胰岛素注射到运动活跃的部位使其吸收加速而增加低血糖发生风险;4)间断高强度运动可增高血糖而持续中等强度运动则使血糖降低,在持续中等强度有氧运动结束时,快速短跑10秒钟有助于预防运动后2h的低血糖;有氧运动前进行抗阻运动有助于运动过程中血糖稳定,并减少运动后低血糖的持续时间和严重程度。
同时应警惕夜间低血糖,运动后夜间低血糖风险增加,一项针对青少年的研究发现:白天运动者其夜间低血糖发生率较无运动者大约增加1倍。严重的夜间低血糖多在持续至少1h的中等体力活动后发生,最长可至运动后24h。1)若睡前血糖< 7.0mmol/L,应给予补充碳水化合物,确保睡前血糖高于7.0mmol/L;2)减少运动日基础胰岛素剂量10-20%,在某些情况下甚至减少50%;3)若白天有运动,睡前进食至少10-15克碳水化合物,最好是低生糖指数食物或混合餐,如一杯牛奶,有助于葡萄糖缓慢而持续吸收入血;4)若日间运动量特别大或持续时间特别长,应设定闹钟在凌晨测血糖,若有需要则进食碳水化合物。
成人患者应将有益的体育运动融入到更加健康的生活方式中。成人患者日常营养和体力活动模式变化颇大,自我监测和胰岛素注射方案需要仔细而详尽的审查,包括所有适当的准备,并考虑到不寻常的模式及组合。尤其注意,运动时涉及胰岛素的剂量调整,具体可参见表6.4。
3.其他注意事项
1)为避免脱水,运动时应及时补充无糖液体;2)若运动前无法检测酮体,当患者感到恶心时,要考虑可能存在酮症,此时不应参与运动;3)参加受限制的运动如需要水中呼吸器的潜水前,应由专业人员严格评估后再确定能否给参加,因该项运动常导致血糖大幅波动;当进行不同于往常的锻炼如露营等项目时,为避免低血糖,全天胰岛素总量要大幅减少(约20-50%);4)合并糖尿病视网膜病变患者应避免头低于腰部的运动,有增殖性视网膜病变或肾病的患者应注意避免可能导致高血压的运动项目,如举重、潜水等;5)伴终末期神经病变的患者应避免诸如足球之类的项目;所有外周神经病变的患者应避免过度伸展的运动,并每天检查足部有无早期病变。所有有足部损伤或开放性溃疡的患者应限制于无负重运动如垫上运动或避免患肢负重;6)应根据不同年龄段和不同体重的患者人群选择不同的具体运动方式。
一、胰腺及胰岛移植
自身免疫性T1DM是胰岛细胞特异性自身免疫性疾病,需终身依赖外源性胰岛素治疗。胰腺移植和胰岛移植是目前唯一可部分或完全恢复生理性胰岛素分泌的治疗方法。
1.胰腺移植
胰腺移植已成为治疗T1DM,特别是伴终末期肾脏疾病患者的有效方法。在各种脏器移植中胰腺移植是仅次于肾脏移植、肝脏移植与心脏移植,占第4位的器官移植。胰腺移植能为糖尿病患者提供具有正常功能的胰腺组织,术后能生理性调节胰岛素的分泌,维持正常血糖,阻止和逆转糖尿病并发症的发生,使患者术后的健康状况明显好转,生活质量大大改善。临床上胰腺移植分为三种类型:1)胰肾联合移植:包括分期胰肾移植和同期胰肾联合(Simultaneous Pancreas-Kidney,SPK) 移植;2)肾移植后胰腺 (pancreas after kidney,PAK)移植;3)单纯胰腺(Pancreas Transplantation Alone,PTA)移植。
推荐胰腺移植用于治疗T1DM的指征为:①糖尿病合并尿毒症或即将进展为尿毒症准备接受肾移植术患者,这类患者可以行SPK或PAK手术,其中SPK的胰腺存活率高于PAK。②PTA手术仅适于下列情况:频繁出现严重的急性并发症包括低血糖、严重高血糖、酮症酸中毒;由于临床或精神原因导致外源胰岛素无法使用者。
胰腺移植术后并发症的发生率高,包括术后血栓形成、移植局部感染、移植胰腺炎、吻合口漏和排斥反应等,占胰腺移植失败原因的9%。急性排异反应和慢性排异反应是引起移植胰岛功能丧失的主要原因。尽管随着新型免疫抑制剂的应用、移植技术的日臻成熟,胰腺移植受体及器官存活率有所提高,但由于创伤性大和术后潜在的严重并发症风险,故胰腺移植绝大多数用于同时需要接受肾脏移植的患者。
2.胰岛移植
胰岛移植是将供者胰腺中的胰岛经体外提取和纯化后通过门静脉移植到肝脏,以弥补严重胰岛功能丧失,改善脆性糖尿病状态,稳定糖代谢。胰岛移植方式更接近生理状态下的胰岛素代谢途径,较胰腺移植具有安全、简单、不良反应轻等优点。胰岛细胞移植能使T1DM患者长期获益,包括长期微血管并发症发生风险降低,生活质量改善,严重低血糖反应显著减少或消除。临床胰岛移植技术经历近40年的探索,发展至今无论是胰岛分离技术还是移植治疗途径与免疫抑制方案均取得了长足的进步。临床上胰岛移植分为三种类型:1)胰岛细胞移植; 2)肾移植后胰岛移植;3)胰岛细胞联合肾脏移植。
胰岛移植用于治疗T1DM的指征包括:1)年龄18岁至65岁;2)血清C肽<0.3ng/ml或<100pmol/L;3)需要强化糖尿病治疗(血糖测定≥3次/日,注射胰岛素≥3次/日,或需装置胰岛素泵);4)近12个月内发生1次以上严重低血糖事件;5)糖尿病患者因肾功能不全行肾移植时间≥3个月,目前采用钙抑制剂免疫抑制治疗,肾功能稳定,胰岛移植前3个月肌酐不超过正常上限的1.3倍。
同其它器官移植类似,胰岛移植后仍存在受体对胰岛移植物因慢性免疫排斥而导致的胰岛功能随移植时间延长而逐渐降低。目前影响胰岛移植效果的主要因素有:①移植胰岛的数量;②移植胰岛的质量;③移植部位;④免疫排斥。随着新型免疫抑制剂的开发及免疫耐受诱导方案的发展,异种胰岛移植也有望成为糖尿病治疗的有效方法。胰岛移植成功指胰岛移植接受者脱离胰岛素注射治疗或胰岛素用量减少伴脆性糖尿病改善。胰岛移植失败指胰岛移植后仍无胰岛素分泌,血清空腹C肽<0.3 ng/ml或<100pmol/L。
在我国,仅有个别医院报道个别短期胰岛移植成功的病例。长期、大样本的胰岛素移植成功尚没有报道。
3.干细胞治疗
目前干细胞治疗糖尿病尚处于临床应用前的研究和观察阶段。目前尚不能用于临床常规治疗。
4.口服降糖药
胰岛素是治疗T1DM的基石,患者需依赖胰岛素维持生命。T1DM不能单独采用口服降糖药物治疗。目前不推荐用口服药物治疗糖尿病。